
| A. | Ca2+、K+、Cl-、NO3- | B. | NH4+、Fe3+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
分析 AG=lg[c(H+)/c(OH-)],常温下,在AG=1的溶液中,c(H+)/c(OH-)=0.1,溶液显碱性,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.碱性溶液中不能大量存在Ca2+,故A不选;
B.Fe3+、I-发生氧化还原反应,且碱性溶液中不能大量存在NH4+、Fe3+,故B不选;
C.ClO-、S2-发生氧化还原反应,故C不选;
D.碱性溶液中该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁合金的硬度比镁小 | |
| B. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| C. | 纯碱可作治疗胃酸过多的一种药剂 | |
| D. | SO2可用于漂白一切有色物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 依据分子中含有氢原子的数目,将酸分为一元酸、二元酸等 | |
| B. | 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| D. | 根据分散质粒子直径的大小,将分散系分为浊液、胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.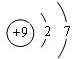 .
.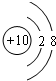 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K、Cl-、MnO4-、SO42- | B. | Na+、SiO32-、NO3-、CO32- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Na+、SO42-、HS-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氧气中燃烧时,存在化学键的断裂和形成 | |
| B. | 有化学键断裂的过程一定是化学变化 | |
| C. | 化学反应过程中,所有反应物中都要断裂化学键 | |
| D. | 干冰升华时,分子中的共价键发生断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com