
分析 NH4Cl与氨水的混合溶液中存在氨水的电离平衡、水的电离平衡以及铵根离子的水解平衡,先分析溶液中存在的离子,再根据电荷守恒分析即可解答.
解答 解:NH4Cl溶液完全电离出铵根离子和氯离子,NH4Cl=Cl-+NH4+,存在水的电离平衡H2O?H++OH-,铵根离子可以发生水解NH4++H2O?NH3•H2O+OH-,所以溶液中的离子有:Cl-、NH4+、OH-、H+,根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-);常温下,将0.1mol/L的NH4Cl溶液与0.1mol/L的氨水溶液等体积混合,混合液的pH=7,溶液显示中性,c(H+)=c(OH-),所以c(NH4+)=c(Cl-),因等体积混合溶液体积增大一倍,所以氯离子浓度为原浓度的一半,即c(NH4+)=c(Cl-)=$\frac{0.1mol/L}{2}$=0.05mol/L,
故答案为:0.05;0.05.
点评 本题考查离子浓度的计算,正确分析溶液中存在的离子以及根据电荷守恒是解答关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加热前消耗的多 | |
| B. | 加热后消耗的多 | |
| C. | 加热前后均消耗0.02amolHCl | |
| D. | 当n(NaOH)>n(NaHCO3)时消耗的才会一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | F2>Cl2>Br2>I2 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | HF<HCl<HBr<HI | D. | CH4<SiH4<GeH4<SnH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | .5 4 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
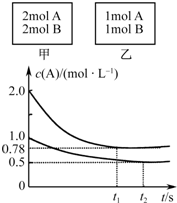 向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )| A. | 甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙) | |
| B. | x不可能等于2 | |
| C. | 将乙容器升温可使甲、乙容器内各物质的体积分数相同 | |
| D. | 若向甲容器中再充入2mol A、2mol B,则平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com