
分析 由于盐酸过量,则镁、铝都完全反应,根据金属的质量关系和得失电子守恒来列方程计算Mg、Al的各自物质的量,根据m=nM计算Al的质量,进而计算Al的质量分数,结合H元素化合价变化计算转移电子数目.
解答 解:标准状况下,氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,
因盐酸足量,金属完全反应,设镁、铝的物质的量分别为x mol和y mol,则:
$\left\{\begin{array}{l}{24x+27y=5.1}\\{2x+3y=0.25×2}\end{array}\right.$,
解得x=0.1,y=0.1mol,
(1)铝的质量分数为$\frac{0.1mol×27g/mol}{5.1g}$×100%=52.9%,
答:该合金中铝的质量分数为52.9%;
(2)该合金中镁和铝的物质的量之比为0.1mol:0.1mol=1:1,
答:该合金中镁和铝的物质的量之比为1:1;
(3)反应中H元素化合价由+1价降低为0价,反应中转移电子数为0.25mol×2×6.02×1023mol-1=3.01×1023,
答:反应中转移电子数为3.01×1023个.
点评 本题考查混合物计算、金属与酸的反应,比较基础,也可以利用方程式进行解答.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeC12溶液 | 变红 | C12具有还原性 |
| B | 滴有石蕊的NaOH溶液 | 褪色 | C12具有酸性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | C12具有漂白性 |
| D | KI淀粉溶液 | 变蓝 | C12具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  O3转变为O2能量曲线可用图表示 | |
| B. | O3转变为O2为氧化还原反应 | |
| C. | 臭氧层中氟里昂释放出的氯原子是O3分解的催化剂 | |
| D. | t℃时,3O2(g)?2O3(g),K′≈3.33×10-77 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
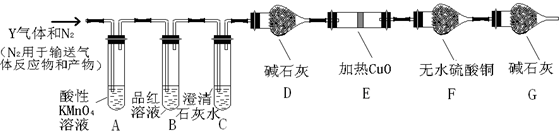
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═[Al(OH)4]-+H2↑ | |
| B. | 向氯化铵的稀溶液中加入少量NaOH NH4++OH-═NH3↑+H2O | |
| C. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向浓硝酸中加入铜片Cu+4H++2N03-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
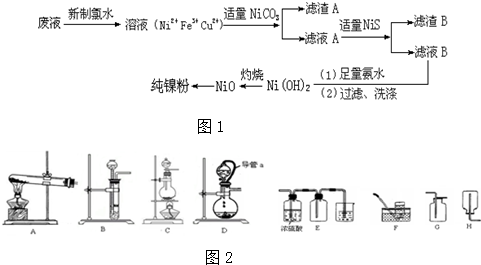
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com