
| A. | 向CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2═HSO3-+HClO | |
| C. | 在FeSO4溶液中加入H2O2溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 在澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.向CaCl2溶液中通入CO2,不发生反应;
B.发生氧化还原反应生成硫酸钙;
C.电子、电荷不守恒;
D.少量小苏打完全反应,生成碳酸钙、水、NaOH.
解答 解:A.向CaCl2溶液中通入CO2,不发生反应,不能写离子反应,故A错误;
B.漂白粉溶液中通入过量SO2的离子反应为Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++2Cl-+SO42-,故B错误;
C.在FeSO4溶液中加入H2O2溶液,离子反应为2Fe2++H2O2+2H+═2Fe3++2H2O,故C错误;
D.在澄清石灰水中加入少量小苏打溶液,离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纯净物 X、Y、Z 转化关系如右图所示,下列判断不正确的是( )
纯净物 X、Y、Z 转化关系如右图所示,下列判断不正确的是( )| A. | X 可能是金属铜 | B. | Y 可能是氢气 | ||
| C. | Z 不可能是氯化钠 | D. | Z 可能是三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
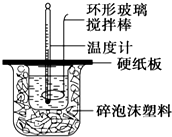 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.6mol/L | D. | 0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

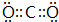 ;N的最高价氧化物与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O.
;N的最高价氧化物与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com