
����Ŀ��ij�о�С��������ͼװ��̽���¶ȶ�CO��ԭFe2O3��Ӱ��(�̶�װ����)
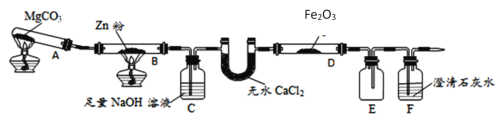
(1)ͼ��ʢ��ˮCaCl2����������Ϊ______װ��B�еĻ�ѧ��Ӧ����ʽΪ_______��
(2)װ��C�з�����Ӧ�����ӷ���ʽΪ_________������β���ķ���Ϊ________��
(3)���о�С���Ϊ���飬����ͼװ�ý��жԱ�ʵ�飬̽����ͬ�¶������º�ɫ����ijɷ֣������þƾ��ơ������þƾ���ƶ�װ��D���ȣ���Ӧ�����Ϊ��ɫ��ĩ(������)������ֱ��ò����������ʵ�飺
���� | ���� | �������� | �������� |
1 | ȡ��ɫ��ĩ�������� | �ܽ⣬������ | �ܽ⣬������ |
2 | ȡ����1����Һ���μ�K3[Fe(CN)6]��Һ | ��ɫ���� | ��ɫ���� |
3 | ȡ����1����Һ���μ�KSCN��Һ | ��� | ������ |
4 | ȡ����3��Һ�еμ�������ˮ | ��ɫ��ȥ | �ȱ�죬����ɫ |
������õ��ĺ�ɫ��ĩ�ɷ���________��
�ڸ��ݼ���ʵ������д�����鲽��1�з�Ӧ�����ӷ�ʽ__________��
�����鲽��4�У���Һ����ԭ��Ϊ________����Һ��ɫ���ܵ�ԭ��________������֤����Ϊ________��
���𰸡�U�θ���� Zn+CO2=ZnO+CO CO2+2OH-=CO32��+H2O ��ȼ���������ռ� Fe Fe3O4+8H+��2Fe3++Fe2++4H2O Fe2+������ΪFe3+��Fe3+��SCN-�Ժ�ɫ ����SCN-��Cl2���� ����Һ�м���KSCN��Һ�������ֺ�ɫ����������
��������
��1��ͼ��ʢ��ˮCaCl2����������ΪU�θ���ܣ�����װ��B�е������Ƕ�����̼���壬�����ķ�Ӧ�Ƕ�����̼��п����������п��һ����̼��
��2��CO2��Zn��������CO���壬װ��C��NaOH����������CO�л��е�CO2���壻β����CO�����������ȼ�Բ�ȡ��ȼ��������β��������
��3�������ú�ɫ������������Ტ�������壬�����ԭ���غ�����֪�þƾ���Ƶ�����ʵ��õ��Ĺ���ΪFe��
��Fe2O3����ԭ�õ���ɫ����ΪFe3O4���ɴ˿�д����Ӧ�����ӷ���ʽ��
������4����Һ�������Һ��Fe2+��Cl2����ΪFe3+���¡���Һ��ɫ��ԭ�������Cl2��SCN-���������ü������������Һ�л�����Fe3+���ټ�������KSCN��Һ����Һ��죻
��1��ͼ��ʢ��ˮCaCl2����������ΪU�θ���ܣ�����װ��B�е������Ƕ�����̼���壬�����ķ�Ӧ�Ƕ�����̼��п����������п��һ����̼����Ӧ�Ļ�ѧ����ʽ�ǣ�Zn+CO2=ZnO+CO��
�ʴ�Ϊ��U�θ���ܣ�Zn+CO2=ZnO+CO��
��2�����ʵ��Ŀ�Ŀ�֪��װ��B����CO2��Zn��������CO���壬�������װ�ý���ʵ�飬��װ��C��NaOH����������CO�л��е�CO2���壬���ӷ���ʽ�ǣ�CO2+2OH-=CO32��+H2O��CO���岻һ����ȫ��Ӧ�����β���л���CO�����������ȼ�Բ�ȡ��ȼ��������β��������
�ʴ�Ϊ��CO2+2OH-=CO32��+H2O����ȼ���������ռ���
��3�������ú�ɫ������������Ტ�������壬��ϡ�ԭ���غ㡱��֪�þƾ���Ƶ�����ʵ��õ��Ĺ���ΪFe��
�ʴ�Ϊ��Fe��
�����ü��������֪Fe2O3��CO�ھƾ��Ƽ��ȵ������£�Fe2O3����ԭ�õ���ɫ����ΪFe3O4���ɴ˿�д����Ӧ�����ӷ���ʽ��
�ʴ�Ϊ��Fe3O4+8H+��2Fe3++Fe2++4H2O ��
����Fe3+��SCN-�Ժ�ɫ�����Բ���4����Һ�������Һ��Fe2+��Cl2����ΪFe3+���¡���Һ��ɫ��ԭ�������Cl2��SCN-���������ü������������Һ�л�����Fe3+���ټ�������KSCN��Һ����Һ��죬
�ʴ�Ϊ��Fe2+������ΪFe3+��Fe3+��SCN-�Ժ�ɫ������SCN-��Cl2����������Һ�м���KSCN��Һ�������ֺ�ɫ������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��1����������ҺA��B��1 mL���ֱ��ˮϡ�͵�1000 mL����pH����Һ����Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
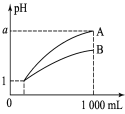
����a<4����A��B��������
��ϡ�ͺ�A����Һ�����Ա�B����Һǿ
����a��4����A��ǿ�ᣬB������
��A��B��������Һ�����ʵ���Ũ��һ�����
A.�٢�B.�ڢ�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ������֮һ�������ɶ���Ӿ��ಽ��Ӧ�ϳɡ�
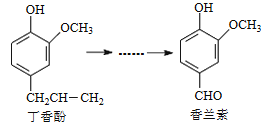
�й��������ֻ������˵����������
A.������������ض�����H2�����ӳɷ�Ӧ
B.�����£�1 mol������������1 mol Br2
C.����Ӻ���������FeCl3��Һ���ܷ�����ɫ��Ӧ
D.�����£�������������ض�����Ũ��ˮ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǻ���������������ռ����Ҫ�ĵ�λ���������е���һЩ��Ȼ�Ļ�ϳɵ��������ϣ�
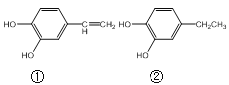

������˵����ȷ���ǣ� ��
A.������ˮ��Ӧ����ˮ��ɫ˵�������к���̼̼˫��
B.�ۢ����������ͬ���������ǵ�����ͼ��ͬ
C.�����ʵ���������������������Na��Ӧ����������������ͬ
D.1mol������������ˮ��Ӧ������3molBr2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10mol/L������������Һ�ζ�10.00mL0.10mol/L������Һ��ˮ�ĵ����������������Һ����ı仯������ͼ��ʾ������˵����ȷ����( )

A.�õζ�����Ӧ��ѡ�������Ϊָʾ��
B.N����Һ��c(OH-)=c(CH3COO-)+c(CH3COOH)+c(H+)
C.��P�㵽N�㣬��Һ��ˮ�ĵ���̶�������
D.M���Ӧ��NaOH��Һ�����Ϊ10.00mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ�����ˮʱij��Ӧ��ϵ����6�����ӣ�N2��HCO3-��ClO-��CNO-��H2O��Cl-���ڷ�Ӧ�����в�������Ũ���뷴Ӧ���̹�ϵ��ͼ��ʾ�������йظ÷�Ӧ��˵����ȷ���ǣ� ��

A. ��������Ӧ��ϵ�У�CNO����������
B. ��ԭ������������������ʵ���֮��Ϊ1��3
C. �ڱ�״���£�����4.48 L N2ʱת��0.8 mol����
D. ������Ӧ�У�ֻ������Ԫ�ػ��ϼ۷����˱仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ̽��Cu��NO�ķ�Ӧ���������ϣ���Cu��NO��Ӧ������CuO��N2�������������£�NO��NO2�C������MnO4�C��Ӧ����NO3�C��Mn2+
��1��ʵ��������Cu��ϡHNO3�Ʊ�NO��д����Ӧ�Ļ�ѧ����ʽ_____________��
��2��ѡ����ͼ��ʾװ�����Cu��NO��ʵ�顣(�г�װ����) ʵ�鿪ʼǰ����װ����ͨ��һ��ʱ���N2���ش��������⣺
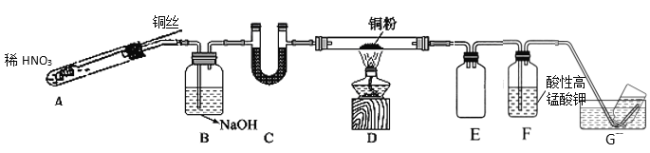
��ʹ��ͭ˿���ŵ���_____________________װ��E������Ϊ_______________��
��װ��C��ʢ�ŵ�ҩƷ������_________��
��װ��D�е�������_______________��װ��F�з�Ӧ�����ӷ���ʽ��_______________��
��3���ⶨNaNO2��NaNO3 �����Һ��NaNO2��Ũ�ȡ� ȡ25.00mL�����Һ����ƿ�У���0.1000mol��L��1����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.90 | 20.12 | 20.00 | 19.88 |
����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________������ĸ���ţ���
a����ƿϴ����δ����
b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
c���ζ��յ�ʱ���Ӷ���
d������KMnO4��Һ�к��������������Լ�
e����ƿϴ�����ô���Һ��ϴ
������KMnO4��Һ�ζ�����������Һ�����ӷ���ʽΪ___________________��
��NaNO2 �����ʵ���Ũ��Ϊ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)4��̼ԭ�Ӽ���Ե�����ϵķ�ʽ��4�֣���������ķ����в�������3�ֽ�Ϸ�ʽ��________________

(2)д��̼ԭ����Ϊ5��������ͬ���칹��Ľṹ��ʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㶹�ة�4��һ�ּ���Ⱦ�ϣ�Ӧ���ڿɵ�гȾ�ϼ��������㶹�ة�4��C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�������й�������ȷ����( )
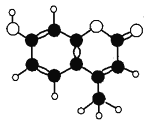
�� ����ʽΪC10H9O3 �� ����Br2ˮ����ȡ����Ӧ
������Br2ˮ�����ӳɷ�Ӧ ����ʹ����KMnO4��Һ��ɫ
�� 1mol�㶹�ة�4�������2molNaOH����Һ��Ӧ
A.�٢ڢ�B.�ۢܢ�C.�ڢۢ�D.�ڢۢܢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com