
| A、向AgCl悬浊液中加入KI溶液:Ag++I-=AgI↓ |
| B、向Ba(OH)2溶液中滴加少量CuSO4溶液:Ba2++SO42-=BaSO4↓ |
| C、向Ca(HCO3)2溶液中滴加少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、向NaClO的碱性溶液中滴加少量CoCl2生成Co(OH)3沉淀:2Co2++ClO-+5H2O=2Co(OH)3↓+Cl-+4H+ |


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | C2H4 | 溴水 | 溶液褪色 | 乙烯能与溴 发生加成反应 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有还原性 |
| D | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x的取值范围是0<x≤0.25 | ||
| B、无论x为何值,当加入87.5 mL的KOH时,溶液中的阳离子恰好完全沉淀 | ||
| C、当100 mL KOH刚好完全消耗,且Al3+全部转化为AlO2-时,x的值为0.2 | ||
D、若反应前Al3+的物质的量为a mol,则a=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁腐蚀时负极发生的反应:Fe→Fe 3++3e- | ||
| B、明矾水解的离子方程式:Al3++3H2O?Al(OH)3(胶体)+3H+ | ||
C、小苏打在水中的电离方程式:NaHCO3=Na++H++C
| ||
| D、1 g氢气在空气中完全燃烧生成液态水时放出285.8 kJ热量,其热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | NO2 | SiO2 |
| 熔点℃ | 920 | 801 | 1291 | 190 | -107 | 2073 | -93 | 1723 |
| c(N2O4) |
| c2(NO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银镜反应实验后附着银的试管,可用稀H2SO4清洗 |
| B、在中学“硫酸铜晶体中结晶水含量测定”的实验中,称量操作至少需要三次 |
| C、不慎将浓H2SO4溅在皮肤上,立即用NaOH溶液冲洗 |
| D、在500 mL烧杯中,加入216g水和24gNaOH固体,配制10%NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度下,0.31 mol?L-1 HF溶液的pH=2 |
| B、升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C、两溶液混合后不会产生沉淀 |
| D、向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
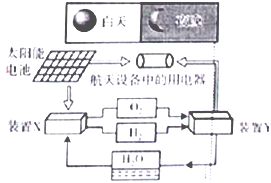 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com