
ĻĀĮŠŹµŃé”°ŹµŃé²Ł×÷”±Óė”°½įĀŪ”±¶ŌÓ¦¹ŲĻµÕżČ·µÄŹĒ
Ń”Ļī | ŹµŃé²Ł×÷ | ½įĀŪ |
A | ĻņFe(NO3)2ČÜŅŗµÄŹŌ¹ÜÖŠ¼ÓČėĻ”H2SO4 £¬ŌŚ¹ÜæŚ¹Ū²ģµ½ŗģ×ŲÉ«ĘųĢå | HNO3·Ö½āÉś³ÉĮĖNO2 |
B | Ļņ·ŠĖ®ÖŠÖšµĪ¼ÓČė1”«2 mL FeCl3±„ŗĶČÜŅŗ£¬Öó·ŠÖĮŗģŗÖÉ«ŅŗĢå | ÖʱøFe(OH)3½ŗĢå |
C | ³£ĪĀĻĀ£¬Ļņ±„ŗĶ | ĖµĆ÷³£ĪĀĻĀ
|
D | Ļņ“æ¼īÖŠµĪ¼Ó×ćĮæÅØŃĪĖį£¬½«²śÉśµÄĘųĢåĶØČė±½·ÓÄĘČÜŅŗ£¬ČÜŅŗ±ä»ė×Ē | ĖįŠŌ£ŗŃĪĖį£¾Ģ¼Ėį£¾±½·Ó |
B
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗA”¢ĻņFe£ØNO3£©2ČÜŅŗÖŠ¼ÓČėH2SO4£¬Ōņ»į·¢ÉśĄė×Ó·“Ó¦£ŗ3Fe2++NO3-+4H+£½3Fe3++NO”ü+2H2O£¬²śÉśµÄNOŌŚ¹ÜæŚÉś³ÉNO2³ŹĻÖŗģÉ«£¬¶ų²»ŹĒHNO3·Ö½ā²śÉśNO2£¬¹ŹA“ķĪó£»B”¢ŌŚ¼ÓČȵÄĢõ¼žĻĀ£¬ĀČ»ÆĢśÓė·ŠĖ®·“Ӧɜ³ÉĒāŃõ»ÆĢś½ŗĢ壬BÕżČ·£»C”¢Ö»ŅŖČÜŅŗÖŠ±µĄė×ÓÅضČÓėĢ¼ĖįøłĄė×ÓÅضČÖ®»ż“óÓŚĢ¼Ėį±µµÄČܶȻż³£Źż¼“æÉŠĪ³ÉĢ¼Ėį±µ³Įµķ£¬ÓėĮņĖį±µµÄČܶȻż³£Źż“󊔲¢ĪŽÖ®¼ä¹ŲĻµ£¬C“ķĪó£»D”¢ÅØŃĪĖįŅ×»Ó·¢£¬Ņņ“ĖÉś³ÉµÄCO2ĘųĢåÖŠŗ¬ÓŠĀČ»ÆĒāĘųĢ壬ĀČ»ÆĒāÓė±½·ÓÄĘŅ²·“Ӧɜ³É±½·Ó£¬Ņņ“Ė²»ÄÜĖµĆ÷Ģ¼ĖįµÄĖįŠŌĒæÓŚ±½·Ó£¬D“ķĪ󣬓š°øŃ”B”£
æ¼µć£ŗæ¼²é»ÆѧŹµŃé·½°øÉč¼ĘÓėĘĄ¼Ū



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”»ŻÖŻŹŠøßČżµŚ¶ž“Īµ÷ŃŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ³ĀŹö¢ń”¢¢ņÕżČ·²¢ÓŠŅņ¹ū¹ŲĻµµÄŹĒ
Ń”Ļī | ³ĀŹö¢ń | ³ĀŹö¢ņ |
A | Ēā·śĖį¾ßÓŠĖįŠŌ | Ēā·śĖįæÉÓĆÓŚµńæĢ²£Į§ |
B | SO2ÓŠŃõ»ÆŠŌ | SO2æÉÓĆÓŚĘÆ°×Ö½½¬ |
C | NH3¼«Ņ×ČÜÓŚĖ® | NH3æÉÓĆ×÷ÖĘĄä¼Į |
D | ClO2¾ßÓŠĒæŃõ»ÆŠŌ | ClO2æÉÓĆÓŚ×ŌĄ“Ė®µÄɱ¾śĻū¶¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”·šÉ½ŹŠøßČż10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(16·Ö)Ģ¼”¢µŖ”¢Įņ”¢ĀČŹĒĖÄÖÖÖŲŅŖµÄ·Ē½šŹōŌŖĖŲ”£
£Ø1£©CH4(g)ŌŚO2(g)ÖŠČ¼ÉÕÉś³ÉCO(g)ŗĶH2O(g)µÄ”÷HÄŃŅŌÖ±½Ó²āĮ棬ŌŅņŹĒ
£Ø2£©¹¤ŅµÉĻŗĻ³É°±ĘųµÄ·“Ó¦ĪŖ£ŗN2(g) + 3H2(g)  2NH3(g) ”÷H<0”£ĻÖ½«10 mol N2ŗĶ26 mol H2ÖĆÓŚČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬N2µÄĘ½ŗā×Ŗ»ÆĀŹ(
2NH3(g) ”÷H<0”£ĻÖ½«10 mol N2ŗĶ26 mol H2ÖĆÓŚČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬N2µÄĘ½ŗā×Ŗ»ÆĀŹ(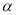 )ÓėĢåĻµ×ÜŃ¹Ēæ(P)”¢ĪĀ¶Č(T)µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
)ÓėĢåĻµ×ÜŃ¹Ēæ(P)”¢ĪĀ¶Č(T)µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł·“Ó¦“ļµ½Ę½ŗāדĢ¬BŹ±£¬ČŻĘ÷µÄČŻ»ż10 L£¬ŌņT1Ź±£¬ŗĻ³É°±·“Ó¦µÄĘ½ŗā³£ŹżK= ”£
¢ŚĘ½ŗāדĢ¬ÓÉA±äµ½CŹ±£¬¶ŌÓ¦µÄĘ½ŗā³£ŹżK(A) K(C)(Ģī”°>”±”¢”°<”±»ņ”°=”±)”£
¢ŪĘ½ŗāדĢ¬ÓÉA±äµ½BŹ±£¬¶ŌÓ¦µÄĘ½ŗā³£ŹżK(A) K(B)(Ģī”°>”±”¢”°<”±»ņ”°=”±)”£
£Ø3£©ŌŚ25”ꏱ£¬HSCN”¢HClO”¢H2CO3µÄµēĄė³£ŹżČēĻĀ±ķ£ŗ
HClO | HSCN | H2CO3 |
K=3.2”Į10-8 | K=0.13 | Kl=4.2”Į10-7 K2=5.6”Į10-11 |
¢Ł1 mol”¤L-1µÄKSCNČÜŅŗÖŠ£¬ĖłÓŠĄė×ÓµÄÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ
¢ŚĻņNa2CO3ČÜŅŗÖŠ¼ÓČė¹żĮæHClOČÜŅŗ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ
¢ŪĶ¬ÅØ¶ČµÄA.NaClO B. Na2CO3 C. NaSCN ±Č½Ļø÷ČÜŅŗpHÓɓ󵽊”µÄŹĒ £ØÓĆA.B.C»Ų“š£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”·šÉ½ŹŠøßČż9ŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¶ĢÖÜĘŚŌŖĖŲµÄX”¢Y”¢Z”¢WŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬XŌ×Ó×īĶā²ćµē×ÓŹżŹĒµē×Ó²ćŹżµÄČż±¶£¬YÓėXæÉŠĪ³ÉY2X2ŗĶY2XĮ½ÖÖĄė×Ó»ÆŗĻĪļ£¬ZŌ×ÓµÄŗĖĶāµē×ÓŹż±ČŌ×ÓYŌ×Ó¶ą1£¬WÓėXĶ¬Ö÷×壬Ōņ
A£®ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗX£¾W
B£®µ„ÖŹµÄ»¹ŌŠŌ£ŗY£¾Z
C£®Ō×Ó°ė¾¶£ŗY£¼Z£¼W
D£®YŗĶZĮ½Õß×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÄÜĻą»„·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”·šÉ½ŹŠøßČż9ŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
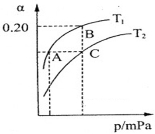
ŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£ŗCO(g)+2H2(g) CH3OH(g) £¬ĘäĖūĢõ¼ž²»±ä£¬ŌŚ300”ęŗĶ500”ꏱ£¬ĪļÖŹµÄĮæn(CH3OH)-·“Ó¦Ź±¼ätµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
CH3OH(g) £¬ĘäĖūĢõ¼ž²»±ä£¬ŌŚ300”ęŗĶ500”ꏱ£¬ĪļÖŹµÄĮæn(CH3OH)-·“Ó¦Ź±¼ätµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
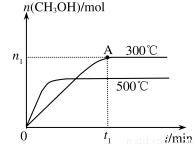
A£®øĆ·“Ó¦µÄ”÷H>0
B£®ĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č·“Ó¦µÄĘ½ŗā³£ŹżŌö“ó
C£®300”ꏱ£¬0-t1minÄŚ CH3OHµÄĘ½¾łÉś³ÉĖŁĀŹĪŖ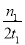 mol”¤L£1 min£1
mol”¤L£1 min£1
D£®AµćµÄ·“Ó¦ĢåĻµ“Ó300”ęÉżøßµ½500”ę£¬“ļµ½Ę½
ŗāŹ±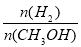 ¼õŠ”
¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”·šÉ½ŹŠøßČż9ŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄŹżÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®1mol SŌŚ×ćĮæO2ÖŠČ¼ÉÕ£¬×ŖŅʵĵē×ÓŹżĪŖ6 NA
B£®±źæöĻĀ£¬22.4Lŗ¤Ęųŗ¬ÓŠµÄŌ×ÓŹżĪŖ2NA
C£®28 g C2H4ÖŠŗ¬ÓŠ2 NAøöĢ¼Ō×Ó
D£®0.1 mol”¤L£1µÄĢ¼ĖįĒāÄĘČÜŅŗÖŠŗ¬ÄĘĄė×ÓŹżĪŖ0.1NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”֊ɽŹŠøßČżÉĻѧʌµŚ¶ž“ĪÄ£Äāæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
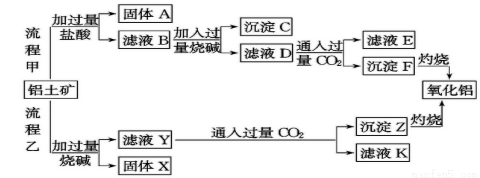
£Ø12·Ö£©“ÓĀĮĶĮæó£ØÖ÷ŅŖ³É·ÖŹĒAl2O3£¬ŗ¬SiO2”¢Fe2O3”¢MgOµČŌÓÖŹ£©ÖŠĢįČ”Ńõ»ÆĀĮµÄĮ½ÖÖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Į÷³Ģ¼×¼ÓČėŃĪĖįŗóÉś³ÉAl3+µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ £»
£Ø2£©Į÷³ĢŅŅ¼ÓČėÉÕ¼īŗóÉś³ÉSiO32-µÄĄė×Ó·½³ĢŹ½ĪŖ______”£
£Ø3£©ŃéÖ¤ĀĖŅŗBŗ¬Fe3+£¬æÉȔɣĮæĀĖŅŗ²¢¼ÓČė______£ØĢīŹŌ¼ĮĆū³Ę£©”£
£Ø4£©ĀĖŅŗEÖŠČÜÖŹµÄÖ÷ŅŖ³É·ÖŹĒ____(Ģī»ÆѧŹ½)£¬Š“³öøĆČÜŅŗµÄŅ»ÖÖÓĆĶ¾ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”֊ɽŹŠµČĪ劣ĮŖæ¼øßČżµŚŅ»Ń§ĘŚ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
£Ø16·Ö£©Na2S2O3æÉÓĆ×÷ÕÕĻąµÄ¶ØÓ°¼ĮµČ”£ŅŃÖŖNa2S2O3µÄijŠ©ŠŌÖŹČēĻĀ£ŗ
£Ø1£©S2O32-Äܱ»I2Ńõ»ÆĪŖS4O62-£» (2) ĖįŠŌĢõ¼žĻĀS2O32-ŃøĖŁ·Ö½āĪŖSŗĶSO2
¢ń”¢ŹŠŹŪNa2S2O3ÖŠ³£ŗ¬ÓŠSO42-£¬ ĒėĶź³ÉŅŌĻĀ·½°ø£¬¼ģŃéĘäÖŠŗ¬ÓŠµÄSO42-£ŗ
ŹµŃé²½Öč | Ō¤ĘŚĻÖĻó»ņ½įĀŪ |
²½Öč1£ŗȔɣĮæ¹ĢĢåѳʷČÜÓŚĪŽŃõÕōĮóĖ®ÖŠ | ¹ĢĢåĶźČ«ČܽāµĆĪŽÉ«³ĪĒåČÜŅŗ |
²½Öč2£ŗ |
|
²½Öč3£ŗ |
|
¢ņ”¢ĄūÓĆK2Cr2O7±ź×¼ČÜŅŗæÉŅŌ¶ØĮæ²ā¶ØŹŠŹŪĮņ“śĮņĖįÄĘŹŌ¼ĮµÄ“æ¶Č£¬²½ÖčĪŖ£ŗ
¢Ł ČÜŅŗÅäÖĘ£ŗ³ĘČ”1.0g Na2S2O3ŹŌŃł£¬ÓĆŠĀÖ󷊲¢ĄäČ“µÄÕōĮóĖ®Čܽā£¬×īÖÕ¶ØČŻÖĮ100mL”£
¢Ś µĪ¶Ø£ŗČ”10.00mL 0.01mol”¤L-1 K2Cr2O7±ź×¼ČÜŅŗ£¬¼ÓĮņĖįĖį»Æ£¬ŌŁ¼Ó¹żĮæKIČÜŅŗ”£
¢Ū Ķł²½Öč¢ŚĖłµĆČÜŅŗ¼ÓČėijÖøŹ¾¼Į£¬ÓĆNa2S2O3µĪ¶ØÖĮÖÕµć(2S2O32-+ I2 === S4O62-+ 2I-)£¬¼ĒĀ¼Na2S2O3ČÜŅŗÓĆĮæ£¬Ę½ŠŠµĪ¶Ø3“Ī”£
(1) ²½Öč¢ŁÖŠ±ŲŠėŹ¹ÓĆµÄ²£Į§ŅĒĘ÷ÓŠÉÕ±”¢²£Į§°ō”¢ ŗĶ ”£
(2) Ķź³É²¢ÅäĘ½²½Öč¢ŚÖŠµÄĄė×Ó·“Ó¦£ŗ Cr2O72- + ( ) + I-£½ I2 + Cr3+ + H2O”£
(3) ²½Öč¢ŪÖŠ£¬ÖøŹ¾¼Į×īŗĆŃ”ÓĆ £¬øƵĪ¶ØÓ¦ŌŚ½Ó½üÖŠŠŌµÄČÜŅŗÖŠ½ųŠŠ¶ų²»ŌŚĒæĖįŠŌČÜŅŗ½ųŠŠµÄŌŅņŹĒ ”£
(4) Čō3“ĪµĪ¶ØNa2S2O3ČÜŅŗµÄĘ½¾łÓĆĮæĪŖ12.00mL£¬ŌņѳʷµÄ“æ¶ČĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”Ęߊ£øßČżÉĻѧʌµŚŅ»“ĪĮŖæ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚĖ®ČÜŅŗÖŠÄÜ“óĮæ¹²“ęµÄŅ»×éĄė×ÓŹĒ
A£®NH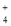 ”¢Na+”¢Cl£”¢SO
”¢Na+”¢Cl£”¢SO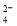 B£®K£«”¢Mg2£«”¢OH£”¢NO
B£®K£«”¢Mg2£«”¢OH£”¢NO
C£®H£«”¢Ca 2£«”¢SiO ”¢NO3£ D£®K£«”¢Al3£«”¢ClO£”¢HCO3£
”¢NO3£ D£®K£«”¢Al3£«”¢ClO£”¢HCO3£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com