
| A. | H2O2分解的热化学方程式为H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98 kJ•mol-1 | |
| B. | 反应速率与Fe2+浓度有关 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | △H1+△H2=196 kJ•mol-1 |
分析 A、根据分解1mol液态H2O2放出热量98kJ结合热化学方程式的书写方法来回答;
B、根据题中反应,可以确定Fe2+为催化剂,催化剂可以改变反应速率;
C、根据元素守恒来判断回答;
D、根据盖斯定律,①+②得到:2H2O2(l)═2H2O(l)+O2(g),计算焓变即可.
解答 解:A、根据信息:分解1mol液态H2O2放出热量98kJ,热化学方程式为:H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98 kJ•mol-1,故A正确;
B、根据题中反应,可以确定Fe2+为催化剂,催化剂可以改变反应速率,反应速率与Fe2+浓度有关,故B正确;
C、根据元素守恒,在H2O2分解过程中,Fe2+和Fe3+的总量保持不变,故C正确;
D、根据盖斯定律,①+②得到:2H2O2(l)═2H2O(l)+O2(g),△H1+△H2=-196 kJ•mol-1,故D错误.
故选D.
点评 本题考查学生化学反应中的能量变化和盖斯定律的应用知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 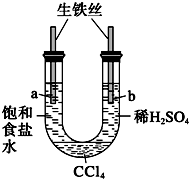 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 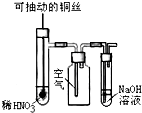 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 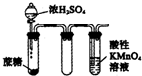 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
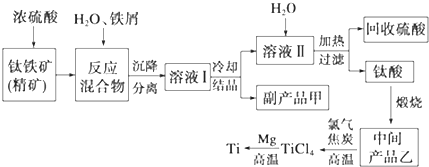
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
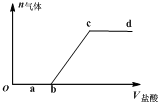 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应溶液中:Ca2+、Mg2+、Br-、NO3- | |
| B. | b点对应溶液中:Al3+、Fe3+、MnO4-、NO3- | |
| C. | c点对应溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
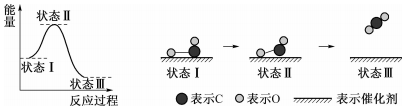
| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO没有断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com