
【题目】下表是元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________________________ 。
(2)表中能形成两性氢氧化物的元素是 ________ (/span>用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 ________________________ 。
(3)④元素与⑦元素形成化合物的电子式 _____________________________ 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ____(填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 ____________ 。
【答案】![]() Al 2Al+2H2O+2OH-=2AlO2-+3H2↑
Al 2Al+2H2O+2OH-=2AlO2-+3H2↑ ![]() HClO4 26
HClO4 26
【解析】
根据元素在周期表中的位置知,①~⑩种元素分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br元素。
(1)这些元素中最不活泼的元素是Ar,其原子核外有18个电子,核外有3个电子层;
(2)表中能形成两性氢氧化物的元素是铝;⑨最高价氧化物的水化物是KOH,铝和KOH溶液反应生成偏铝酸钾和氢气;
(3)④是Mg,⑦是Cl,两种元素形成的化合物MgCl2是离子化合物;Mg2+与Cl-通过离子键结合;
(4)①、②、⑥、⑦四种元素分别是C、N、S、Cl,四种元素最高价氧化物对应的水化物的酸性最强的是HClO4;
(5)③元素与⑩元素两者核电荷数之差=35-9=26。
根据元素在周期表中的位置知,①~⑩种元素分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br元素。
(1)这些元素中最不活泼的元素是Ar,其原子核外有18个电子,核外有3个电子层,其原子结构示意图为![]() ;
;
(2)表中能形成两性氢氧化物的元素是铝;⑨最高价氧化物的水化物是KOH,铝和KOH溶液反应生成偏铝酸钾和氢气,反应方程式为2Al+2KOH+2H2O═2KAlO2+3H2↑;
(3)④是Mg,⑦是Cl,两种元素形成的化合物MgCl2是离子化合物;Mg2+与Cl-通过离子键结合,电子式为![]() ;
;
(4)①、②、⑥、⑦四种元素分别是C、N、S、Cl,四种元素最高价氧化物对应的水化物的酸性最强的是HClO4;
(5)③元素与⑩元素两者核电荷数之差=35-9=26。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
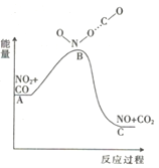
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
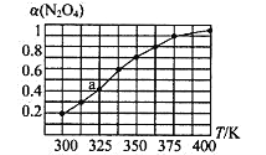
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
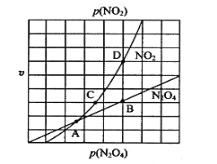
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。
(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
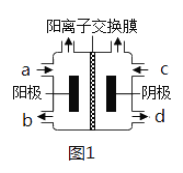
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,在科学上没有错误的是
A.吸带过滤嘴的香烟,对人体无害
B.人工合成的具有生命活性的蛋白质—结晶牛胰岛素,是1965年我国科学家最先合成的
C.纯天然物质配成的饮料,不含任何化学物质
D.蒸馏水绝对纯净,其中不含任何分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. H+由a极通过固体酸电解质传递到b极
D. 每转移0.2 mol电子,消耗1.12 L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏B.分液、蒸馏、萃取
C.萃取、蒸馏、分液D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的组成、性质的说法,正确的是( )
A.水煤气、液化石油气的成分相同
B.葡萄糖、淀粉和乙酸乙酯在一定条件下都能发生水解反应
C.淀粉、蛋白质均属于高分子化合物,而油脂不属于高分子化合物
D.石油的裂解是化学变化,而石油的分馏和煤的干馏都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应m A+n B ![]() p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系__________。
②若A、B、C都是气体,且m + n < p,而加压或升温平衡移动方向相同,则△H ______0
(2)将1molN2和4molH2充入容积为2L的密闭容器中发生:N2(g)+ 3H2(g) ![]() 2NH3(g) ,2分钟后反应达平衡后,N2的浓度为0.25 mol/L,完成:
2NH3(g) ,2分钟后反应达平衡后,N2的浓度为0.25 mol/L,完成:
①N2转化率是____________
②用NH3 表达的化学反应速率为:___________
③平衡常数值是________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com