
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |

分析 向泥料中加入稀硫酸,发生反应Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、CuO+H2SO4=CuSO4+H2O、Cr2O3+3H2SO4=Cr2(SO4)3+3H2O,然后过滤得到滤渣I和滤液I,滤液I中溶质为Fe2(SO4)3、Cr2(SO4)3、CuSO4,向滤液中加入Ca(OH)2,并调节溶液pH,根据流程图中滤液II中含有Cr3+、Cu2+,不含 Fe3+,说明滤渣II中含有Fe(OH)3,硫酸钙属于微溶物,所以沉淀II成分为Fe(OH)3、CaSO4,要使Cr3+、Cu2+不沉淀而Fe3+发生沉淀,根据离子生成沉淀需要pH值知,溶液的pH范围为3.2-4.3之间;向滤液中加入NaHSO3,亚硫酸氢钠具有还原性、铜离子具有氧化性,二者发生氧化还原反应生成硫酸和砖红色沉淀Cu2O,硫酸和亚硫酸氢根离子反应生成二氧化硫,离子方程式为2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O,过滤得到Cu2O,向滤液中加入NaOH并调节溶液pH,发生反应Cr3++3OH-=Cr(OH)3↓,滤液IV中含有NaOH、Na2SO4,据此分析解答.
解答 解:向泥料中加入稀硫酸,发生反应Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、CuO+H2SO4=CuSO4+H2O、Cr2O3+3H2SO4=Cr2(SO4)3+3H2O,然后过滤得到滤渣I和滤液I,滤液I中溶质为Fe2(SO4)3、Cr2(SO4)3、CuSO4,向滤液中加入Ca(OH)2,并调节溶液pH,根据流程图中滤液II中含有Cr3+、Cu2+,不含Fe3+,说明滤渣II中含有Fe(OH)3,硫酸钙属于微溶物,所以沉淀II成分为Fe(OH)3、CaSO4,要使Cr3+、Cu2+不沉淀而Fe3+发生沉淀,根据离子生成沉淀需要pH值知,溶液的pH范围为3.2-4.3之间;向滤液中加入NaHSO3,亚硫酸氢钠具有还原性、铜离子具有氧化性,二者发生氧化还原反应生成硫酸和砖红色沉淀Cu2O,硫酸和亚硫酸氢根离子反应生成二氧化硫,离子方程式为2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O,过滤得到Cu2O,向滤液中加入NaOH并调节溶液pH,发生反应Cr3++3OH-=Cr(OH)3↓,滤液IV中含有NaOH、Na2SO4,
(1)通过以上分析知,滤液I中溶质成分为Fe2(SO4)3、Cr2(SO4)3、CuSO4,故答案为:Fe2(SO4)3、Cr2(SO4)3、CuSO4;
(2)Fe3+完全沉淀需要的pH≥3.2,pH=4.3时Cr3+开始产生沉淀,要使铁离子完全沉淀而其它离子不沉淀,则pH范围为:3.2≤pH<4.3,通过以上分析知,沉淀II成分为Fe(OH)3、CaSO4,故答案为:3.2≤pH<4.3; Fe(OH)3、CaSO4;
(3)亚硫酸氢钠具有还原性、铜离子具有氧化性,二者发生氧化还原反应生成硫酸和砖红色沉淀Cu2O,硫酸和亚硫酸氢根离子反应生成二氧化硫,离子方程式为2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O,
故答案为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O;
(4)当离子浓度≤1×10-5mol•L-1时,可以认为离子沉淀完全,若要使Cr3+完全沉淀,则c(Cr3+)≤1×10-5mol•L-1,c(OH-)=$\root{3}{\frac{Ksp}{c(C{r}^{3+})}}$=$\root{3}{\frac{6.3×1{0}^{-31}}{1{0}^{-5}}}$mol/L=4.0×10-9 mol/L,c(H+)=$\frac{1{0}^{-14}}{4.0×1{0}^{-9}}$=2.5×10-6mol/L,则溶液的pH=-lg2.5×10-6=5.6,
故答案为:5.6;
(5)Cr2O3和Al高温下发生铝热反应生成氧化铝和Cr,反应方程式为Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr,故答案为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
点评 本题考查物质的分离和提纯综合应用,为高考高频点,涉及难溶物的溶解平衡、金属冶炼、基本实验操作等知识点,侧重考查分析、计算及实验操作能力,熟悉流程图中涉及的反应、基本操作,难点是溶度积常数计算.


科目:高中化学 来源: 题型:选择题
| A. | 一个${\;}_{88}^{226}$Ra原子中含有138个中子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra不能和冷水反应置换氢气 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X元素的单质常用于炼铁 | |
| B. | 一定条件下,Z单质与W的常见单质直接化合生成酸性氧化物 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式:-CHO | B. | 溴乙烷的电子式: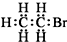 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com