
| A. | 吸热反应 | B. | 放热反应 | ||
| C. | 熵减反应 | D. | 熵增效应大于能量效应 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠和硫的熔化 | B. | 食盐和石蜡的熔化 | ||
| C. | 碘和干冰的升华 | D. | 二氧化硅和氧化钠的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化时,分子中氢氧键发生断裂 | |
| B. | 原子晶体中共价键越强,熔点和沸点越高 | |
| C. | 分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高 | |
| D. | 分子晶体中分子间作用力越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl KCl | B. | CO2 SiO2 | C. | NH4Cl CCl4 | D. | NaOH Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
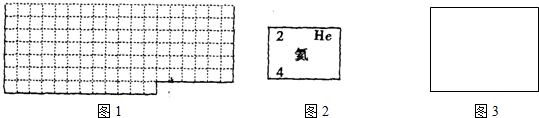
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂没有固体的熔点,因为油脂是混合物 | |
| B. | 油脂是由高级脂肪酸和甘油所生成的酯 | |
| C. | 油脂可以在酸性或碱性条件下水解 | |
| D. | 油脂都不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
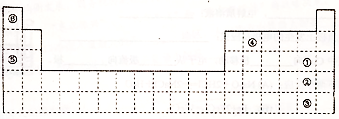
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气
(1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com