
巴豆酸的结构简式为CH3CH=CHCOOH 现有:①氯化氢,②溴水, ③纯碱溶液,④酸性KMnO4溶液, ⑤乙醇,试根据其结构特点,判断在一定条件下能与巴豆酸反应的物质组合是
A.只有②④⑤ B.只有①③④ C.只有①②③ D.都可以
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.常温下, 0.1 mol/L氨水(电离度α=1%)的pH为11:
C.用蒸馏水润湿的试纸测溶液的pH,不一定会使结果偏低
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A.③⑤⑥ B.①② C.③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
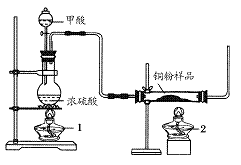
(1)制备一氧化碳的化学方程式是___________________。
(2)实验中,观察到反应管中发生的现象是_____________;尾气的主要成分是_________。
(3)反应完成后,正确的操作顺序为________(填字母)
a.关闭漏斗开关 b.熄灭酒精灯1 c.熄灭酒精灯2
(4)若实验中称取铜粉样品10.0 g,充分反应后,反应管中剩余固体的质量为9.6 g,则原样品中单质铜的质量分数为________。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的最佳方案:
①设计方案的主要步骤是(不必描述操作过程的细节)__________;
②写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是①锌片溶解了32.5克 ②锌片增重了32.5克 ③铜片上析出1克氢气④铜片上析出1mol氢气
A. ①③ B.①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
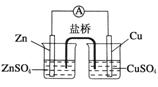 关于如图所示的原电池,下列说法正确的是
关于如图所示的原电池,下列说法正确的是
A. 锌电极发生还原反应,铜电极发生氧化反应
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.电子从锌电极通过电流计流向铜电极
D.铜电极上发生的电极反应为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )
A.电解法 B.热还原性 C.热分解性 D.铝热法
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数, 下列说法正确的是( )
A. 常温常压下,0.1NA个HCl分子的体积为2.24L
B. 标准状况下,22.4L 氖气含有2NA 个原子
C. 1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA
D. 1 mol氖中含有的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com