
电解精炼铜时,阳极泥是怎样形成的?
科目:高中化学 来源: 题型:
①②(3)](2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18克H2O分解成H2和O2时,消耗能量为2×463 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
①步骤3中加氨水后的离子方程式_____________________________________________。
②步骤4为加快过滤速度,常用_________________________________________________(填过滤方法)。
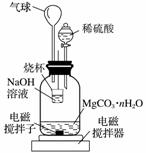
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入右图所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
①图中气球的作用是______________________________________________________
__________________________;
②上述反应后期要升温到30 ℃,主要目的是__________________________________;
③设3次实验测得每1.000 g碳酸镁晶须产生的CO2平均值为a mol,则n值为________________________(用含a的表达式表示)。
(3)称取100 g上述晶须产品进行热重分析,热重曲线如下图。则该条件下合成的晶须中,n=____________(选填:1、2、3、4、5)。

查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式___________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式______________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式____________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式_______________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式_____________________________________________________;
阴极反应式_____________________________________________________;
总反应化学方程式_______________________________________________。
(4)用铁作电极电解NaOH溶液
阳极反应式______________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式_________________________________________________。
(5)用铜作电极电解盐酸溶液
阳极反应式_________________________________________________________;
阴极反应式_________________________________________________________;
总反应离子方程式__________________________________________________。
(6)用Al作电极电解NaOH溶液
阳极反应式________________________________________________________;
阴极反应式________________________________________________________;
总反应离子方程式__________________________________________________。
(7)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式________________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式___________________________________________________。
(8)用Al单质作阳极,石墨作阴极,电解NaHCO3溶液
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
(9)用惰性电极电解熔融MgCl2
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
总反应离子方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据2CrO +2H+??Cr2O
+2H+??Cr2O 7+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为_________________________。
7+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是( )
A.阴极产物是氢气
B.阳极产物是氧气
C.阴极产物是铝和氧气
D.阳极产物只有氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。
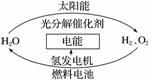
下列说法正确的是( )
A.H2O的分解反应是吸热反应
B.氢能源已被普遍使用
C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com