
下列说法正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 常温下,NH4Cl溶液加水稀释, 增大
增大
C. 0.1 mol·L-1NaCN溶液中含 HCN和CN-总数目为0.1×6.02×1023
D. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2017届天津市部分区高三质量调查(一)化学试卷(解析版) 题型:选择题
常温下,向20 mL 0.1 mol • L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的氢离子浓度随加入硫酸的体积变化如图。下列说法错误的是
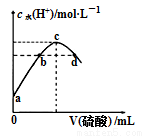
A. 若a等于1.0×10-11 mol • L-1,则此时氨水的电离度为1%
B. c点时氨水与硫酸恰好完全反应
C. c点所示溶液中: c(H+)-c(OH-)=c(NH3•H2O)
D. 若b、d对应的水电离的氢离子浓度为 1.0×10-7 mol • L-1,此时两溶液中都存在:c(NH4+)>2c(SO42-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一下学期3月月考化学试卷(解析版) 题型:选择题
对于反应 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2NO↑+ 4H2O,以下叙述正确的是( )
A. 氧化剂和还原剂的物质的量比为8: 3
B. 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2∶3
C. 该反应的电子转移数为6e-
D. 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(四)化学 试卷(解析版) 题型:简答题
三氯氧磷(POCl3)常温下为无色液体,有广泛应用。近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到)。
(1)氧气直接氧化法产生三氯氧磷的化学方程式是________________;从原理上看,与氯化水解法相比,其优点是____________________。
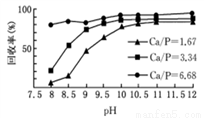
(2)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰将磷元素转化为磷酸的钙盐沉淀并回收。
①漂白粉的主要作用是__________________________。
②下图表示不同条件下对磷的沉淀回收率的影响(“Ca/P”表示钙磷比,及溶液中Ca2+与PO43-的浓度比),则回收时加入生石灰的目的是__________________________。
(3)下述方法可以测定三氯氧磷产品中氯元素含量,实验步骤如下:
Ⅰ.先向一定量产品中加入足量NaOH溶液,使产品中的氯元素完全转化为Cl-;
Ⅱ._________________________;
Ⅲ.再加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与水溶液接触;
Ⅳ.最终加入几滴NH4Fe(SO4)2溶液后,用NH4SCN溶液沉淀溶液中过量的Ag+,并记录NH4SCN的用量。
已知相同条件下的溶解度:AgSCN<AgCl。
①步骤Ⅱ的操作为_______________________。
步骤Ⅳ中当溶液颜色变为____________色时,即表明溶液中的Ag+恰好沉淀完全
②若取消步骤Ⅲ,会使步骤Ⅳ中增加一个化学反应,该反应的离子方程式是________________;该反应使测定结果偏低,运用平衡原理解释器原因:___________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(四)化学 试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 无色澄清透明溶液中:H+、Cu2+、SO42-、Cl-
B. 0.1 mol·L-1AlCl3溶液中:H+、Na+、Cl-、SO42-
C. pH = 13的溶液中:NH4+、K+、NO3-、HCO3-
D. c((OH-) <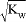 的溶液:Ca2+、Fe2+、NO3-、ClO-
的溶液:Ca2+、Fe2+、NO3-、ClO-
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(四)化学 试卷(解析版) 题型:选择题
乙炔气经CaCl2等净化处理后.在氮气氛围中可催化聚合为聚乙炔,有关表示错误的是
A. 质子数与中子数均为20的钙原子: Ca B. 氮分子的电子式::N:::N:
Ca B. 氮分子的电子式::N:::N:
C. 氯离子(Cl-)的结构示意图: D. 聚乙炔的结构简式:
D. 聚乙炔的结构简式:
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(六)化学试卷(解析版) 题型:简答题
银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)从其中提取银及铜和铅的工艺流程如下:
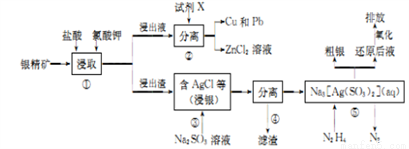
(1)步骤①当盐酸的浓度和KClO3的量一定时,为提高浸取率可采取的措施是___________(举两项)。
(2)步骤②试剂X为____,步骤④滤渣中除含单质硫外,还含有的成分有______。
(3)步骤③反应的化学方程式为____________。
(4)步骤⑤反应的离子方程式为___________。
(5)“还原后液”经氧化后,排放液中溶质的主要成分为_______。
(6)“粗银”(含Ag、Cu、Zn、Au)可用立式电解槽点解精炼,纯银作阴极,电解液采用含Ag60-150g·L-1的硝酸银溶液,可加入含HNO32-8g·L-1的溶液来提高电解液的导电率。
①电解产生的阳极泥中所含金属为______。
②硝酸浓度不能过大,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 12C、13C、14C、金刚石、石墨都是碳元素的同位素
B. 互为同位素的原子,质子数一定相同
C. 同种元素的原子,质量数一定相同
D. 由一种元素组成的物质,一定是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.构成原电池的正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触时锡先被腐蚀
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com