


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
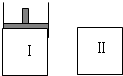 Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):
Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b=2 | B、容器中一定没有残余的CO2和水蒸气 | C、a:b≥1 | D、反应中转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其水溶液导电的一定是离子化合物 | B、熔融态导电的一定是离子化合物 | C、固态导电的一定是金属单质 | D、固态不导电但熔融态导电的一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的溶质是碱 | B、该溶液显碱性 | C、该溶液的溶质是酸 | D、该溶液的溶质是盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com