
ÓŠČżÖ§ŹŌ¹Ü£¬·Ö±š¼ÓČėĻĀĮŠĪļÖŹŗó
¼×£ŗ10 mL 0.01 mol/L FeCl3ČÜŅŗŗĶ10 mL 0.01 mol/L KSCNČÜŅŗ
ŅŅ£ŗ5 mLĖ®”¢10 mL 0.01 mol/L FeCl3ČÜŅŗ5 mL 0.01 mol/L KSCNČÜŅŗ
±ū£ŗ10 mL 0.1 mol/L FeCl3ČÜŅŗŗĶ10 mL 0.1 mol/L KSCNČÜŅŗ
¹Ū²ģÕāČżÖ§ŹŌ¹ÜµÄŃÕÉ«£¬ĘäÖŠŃÕÉ«×īĒ³µÄŹĒ(””””)””””””””””””””””””””””””””””””””””
A£®¼×ŹŌ¹Ü B£®ŅŅŹŌ¹Ü C£®±ūŹŌ¹Ü D£®ĪŽ·ØÅŠ¶Ļ
 ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø
ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø ³å“Ģ100·Öµ„ŌŖÓÅ»ÆĮ·æ¼¾ķĻµĮŠ“š°ø
³å“Ģ100·Öµ„ŌŖÓÅ»ÆĮ·æ¼¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ēė½«ĻĀĮŠĪļÖŹµÄ×Ŗ»Æ»ņ·ÖĄė·½·ØµÄŠņŗÅĢīŌŚŗįĻßÉĻ(ĆæŅ»ĻīÖ»ĢīŠ“Ņ»ÖÖ·½·Ø)”£
¢ŁČܽā ¢ŚĮŃ½ā ¢Ū·ÖĮó ¢ÜĮŃ»Æ ¢ŻøÉĮó ¢ŽÕōĮó ¢ßµē½ā ¢ą¹żĀĖ ¢įŻĶČ”
(1)°ŃĆŗ×Ŗ»ÆĪŖ½¹ĀÆĘų”¢Ćŗ½¹ÓĶŗĶ½¹ĢæµČ________”£
(2)“ÓŌÓĶÖŠ·ÖĄė³öĘūÓĶ”¢ĆŗÓĶ”¢²ńÓĶµČ________”£
(3)½«ÖŲÓĶ×Ŗ»ÆĪŖĘūÓĶ________”£
(4)½«ŗ£Ė®µ»Æ________”£
(5)“Óŗ£Ė®ÖŠµĆµ½µÄĪŽĖ®MgCl2ÖŠĢįČ”½šŹōĆ¾_______
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
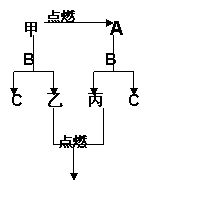 ¼×”¢ŅŅ”¢±ūĪŖČżÖÖµ„ÖŹ£¬A”¢B”¢C ŹĒČżÖÖ
¼×”¢ŅŅ”¢±ūĪŖČżÖÖµ„ÖŹ£¬A”¢B”¢C ŹĒČżÖÖ
³£¼ū»ÆŗĻĪļ£¬AĪŖµ»ĘÉ«¹ĢĢ唣ĖüĆĒÖ®¼äµÄ
×Ŗ»Æ¹ŲĻµČēÓŅĶ¼ĖłŹ¾Ķź³ÉĻĀĮŠæÕ°×£ŗ
£Ø1£©Š“»ÆѧŹ½£ŗA £»B £»
£Ø2£©Š“»Æѧ·½³ĢŹ½£ŗ
¼×+B  C+ŅŅ
C+ŅŅ
A+B  C+¼×
C+¼×
(3)Š“³öAĪļÖŹµÄŅ»ÖÖÖŲŅŖÓĆĶ¾ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ³ä·ÖČ¼ÉÕa g ŅŅČ²ĘųĢåŹ±Éś³É1mol¶žŃõ»ÆĢ¼ĘųĢåŗĶŅŗĢ¬Ė®£¬²¢·Å³öČČĮæbkJ£¬ŌņŅŅČ²Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ( )
A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) ”÷H=£4b kJ/mol
B.C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l) ”÷H=2b kJ/mol
C.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) ”÷H=£2b kJ/mol
D.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) ”÷H=b kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ2 LČŻĘ÷ÖŠ·¢Éś3A£«B===2CµÄ·“Ó¦£¬×ī³õ¼ÓČėµÄA”¢B¶¼ŹĒ4 mol£¬10 s ÄŚAµÄ·“Ó¦ĖŁĀŹĪŖ0.12 mol/(L”¤s)£¬10 sŗóČŻĘ÷ÄŚµÄBµÄĪļÖŹµÄĮæĪŖ (”” ””)
A£®1.6 mol””””B£®2.8 mol C£®3.2 mol D£®3.6 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅĄ¾ŻŹĀŹµ£¬Š“³öĻĀĮŠ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½”£
(1)1 molN2(g)ÓėŹŹĮæO2(g)·“Ӧɜ³ÉNO2(g)£¬ĪüŹÕ68 kJČČĮæ£ŗ
£»
(2)1 molCu(s)ÓėŹŹĮæO2(g)·“Ӧɜ³ÉCuO(s)£¬·Å³ö157 kJČČĮæ£ŗ
£»
(3)ĪĄŠĒ·¢É䏱æÉÓĆėĀ(N2H4)×÷Č¼ĮĻ£¬1 mol N2H4(l)ŌŚO2(g)ÖŠČ¼ÉÕ£¬Éś³ÉN2(g)ŗĶH2O(l)£¬·Å³ö622 kJČČĮæ£ŗ
£»
(4)10g C2H6(g)ĶźČ«Č¼ÉÕÉś³ÉCO2(g)ŗĶH2O(l)£¬·Å³öa kJČČĮ棬Š“³ö±ķŹ¾C2H6Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½£ŗ
£»
(5)ŅŃÖŖ£ŗWO2(s)£«2H2(g)  W(s)£«2H2O(g)¦¤H£½£«66.0 kJ/mol£»WO2(g)£«2H2(g)
W(s)£«2H2O(g)¦¤H£½£«66.0 kJ/mol£»WO2(g)£«2H2(g) W(s)£«2H2O(g)¦¤H£½£137.9kJ/mol”£ŌņWO2(s)
W(s)£«2H2O(g)¦¤H£½£137.9kJ/mol”£ŌņWO2(s) WO2(g)µÄ¦¤H£½________________”£
WO2(g)µÄ¦¤H£½________________”£
(6)ŅŃÖŖ£ŗAl2O3(s)£«AlCl3(g)£«3C(s)==3AlCl(g)£«3CO(g) ¦¤H£½a kJ/mol
2Al(l)£«AlCl3(g)==3AlCl(g)””¦¤H£½b kJ/mol
Ōņ·“Ó¦Al2O3(s)£«3C(s)==2Al(l)£«3CO(g)µÄ¦¤H£½________ kJ/mol(ÓĆŗ¬a”¢bµÄ“śŹżŹ½±ķŹ¾)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
·“Ó¦4NH3£Øg£©+5O2(g) 4NO(g)+6H2O(g)ŌŚ10 LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬°ė·ÖÖÓŗó£¬Ė®ÕōĘųµÄĪļÖŹµÄĮæŌö¼ÓĮĖ0.45 mol£¬Ōņ“Ė·“Ó¦µÄĘ½¾łĖŁĀŹv(X)£Ø·“Ó¦ĪļµÄĻūŗÄĖŁĀŹ»ņÉś³ÉĪļµÄÉś³ÉĖŁĀŹ£©æɱķŹ¾ĪŖ£Ø £©
4NO(g)+6H2O(g)ŌŚ10 LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬°ė·ÖÖÓŗó£¬Ė®ÕōĘųµÄĪļÖŹµÄĮæŌö¼ÓĮĖ0.45 mol£¬Ōņ“Ė·“Ó¦µÄĘ½¾łĖŁĀŹv(X)£Ø·“Ó¦ĪļµÄĻūŗÄĖŁĀŹ»ņÉś³ÉĪļµÄÉś³ÉĖŁĀŹ£©æɱķŹ¾ĪŖ£Ø £©
A.v(NH3)=0.010 mol”¤(L”¤s)-1 B.v(O2)=0.001 mol”¤(L”¤s)-1
C.v(NO)=0.001 0 mol”¤(L”¤s)-1 D.v(H2O)=0.045 mol”¤(L”¤s)-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ÖŠ£¬ÕżČ·µÄŹĒ
A£®Ļ”ĮņĖįµĪŌŚŅųʬÉĻ£ŗ2Ag+2H+=2Ag++H2”ü B£®Ļ”ĮņĖįÓėĒāŃõ»Æ±µČÜŅŗ»ģŗĻ£ŗSO42-+Ba2+=BaSO4”ż
C£®ŃĪĖįµĪŌŚŹÆ»ŅŹÆÉĻ£ŗCaCO3 + 2H+ = Ca2+ + CO2”ü + H2O
D£®°Ń½šŹōÄĘ·ÅČėĖ®ÖŠ£ŗNa + 2H2O = Na+ +2OH- + H2”ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
³£ĪĀĻĀ£¬ÓŠpH = 12µÄNaOHČÜŅŗ100 mL £¬ÓūŹ¹ĖüµÄpH½µĪŖ11”£
£Ø1£©Čē¹ū¼ÓČėÕōĮóĖ®£¬¾Ķ¼ÓČė________ mL £ØŗöĀŌĆÜ¶Č²ī±š£¬ĻĀĶ¬£©
£Ø2£©Čē¹ū¼ÓČėpH = 10µÄNaOHČÜŅŗ£¬Ó¦¼ÓČė_________ mL
£Ø3£©Čē¹ū¼ÓČė0.008 mol/L HClČÜŅŗ£¬Ó¦¼ÓČė__________ mL
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com