
| A. | 已知2H 2(g)+O 2(g)═2H 2O(g);△H=-483.6KJ•mol -1,则氢气的燃烧热为241.8kJ•mol -1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H 2O(1);△H=-57.4kJ•mol -1则含 20.0gNaOH的稀溶液与稀醋酸完全中和,放出小于28.7kJ的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| D. | 己知2C(s)+2O 2(g)═2CO 2(g);△H=akJ•mol -1、2C(s)+O 2(g)═2CO(g);△H=bkJ•mol -1,则a>b |
分析 A.燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,气态水不是稳定氧化物;
B.20.OgNaOH为0.5mol,醋酸是弱酸,其电离过程是吸热过程;
C.物质能量越高越不稳定,△H>0表示正反应吸热;
D.一氧化碳转化为二氧化碳是放热过程;焓变包含负号;
解答 解:A.氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol,气态水不是稳定氧化物,2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则燃烧热>$\frac{483.6KJ•mo{l}^{-1}}{2}$=241.8kJ•mol-1,故A错误;
B.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,指1molNaOH和molHCl溶液发生中和反应生成1mol水时所放出的热量为57.4 kJ,则0.5molNaOH与强酸反应放出$\frac{57.4KJ}{2}$=28.7kJ的热量,醋酸是弱酸,其电离过程是吸热过,20.0g即0.5molNaOH的稀溶液与稀醋酸完全中和,放出小于28.7kJ的热量,故B正确;
C.已知C(石墨,s)═C(金刚石,s)△H>0,石墨能量小于金刚石,则金刚石比石墨活泼,石墨比金刚石稳定,故C错误;
D.己知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol-1、2C(s)+O2(g)═2CO(g)△H=bkJ•mol-1,一氧化碳转化为二氧化碳是放热过程;焓变包含负号,即ab包含正负号,则△H=akJ•mol-1<△H=bkJ•mol-1,a<b,故D错误;
故选:B.
点评 本题考查燃烧热、焓变的意义、物质稳定性以及热化学方程式的含义知识,掌握△H的含义以及热化学方程式概念的运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
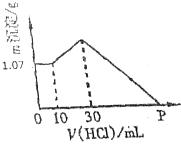 把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求
把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用布朗运动可区别溶液和胶体 | |
| B. | 溶液中通过一束光线时没有明显现象,胶体中通过一束光线时出现明显的光路 | |
| C. | 胶体微粒带电荷,溶液中溶质微粒不带电荷 | |
| D. | 制备Fe(OH)3胶体的方法是:将饱和FeCl3溶液通入热的NaOH溶液中并持续煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键 | |
| B. | 不同元素的原子构成的分子不一定只含极性共价键 | |
| C. | 含极性键的共价化合物一定是电解质 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中:c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 将0.01 mo1•L-1的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c(Cl-) | |
| C. | 在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mo1•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
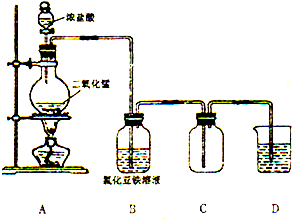 某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】
某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com