
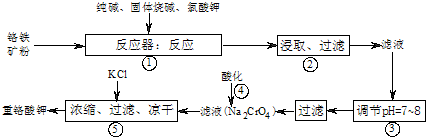
工业上常用铬铁矿(有效成份为FeO·Cr2O3,主要杂质为SiO2、Al2O3)为原料生产重铬酸钾(K2Cr2O7),实验室模拟工业法用铬铁矿制重铬酸钾的主要工艺流程如下图,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O,试回答下列问题:

(1)⑤中溶液金属阳离子的检验方法是 。
(2)步骤③被沉淀的离子为(填离子符号) 。
(3)在反应器①中,二氧化硅与纯碱反应的化学方程式为: 。
(4)烟道气中的CO2可与H2合成甲醇。CH3OH、H2的燃烧热分别为:ΔH=-725.5 kJ/mol、ΔH=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
(5)2011年云南曲靖的铬污染事件,说明含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
①写出电解法处理废水的总反应的离子方程式 。
②已知Cr(OH)3的Ksp=6.3×10–31,若地表水铬含量最高限值是0.1 mg/L,要使溶液中c(Cr3+)降到符合地表水限值,须调节溶液的c(OH-)≥ mol/L(只写计算表达式)。
(1)焰色反应 ;(2)SiO32-、AlO2-;
(3)Na2CO3+SiO2  Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(4)CO2(g)+3H2(g) = CH3OH(l)+H2O(l) ΔH=-131.9 kJ/mol;
(5)① 6Fe+Cr2O72-+2H++17H2O = 6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
② (或
(或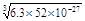 或
或 ;)
;)
【解析】
试题分析:(1)⑤中溶液金属阳离子K+的检验方法是用焰色反应来检验。具体是取光洁无绣的铁丝或Pt丝,用盐酸洗涤后在酒精灯的火焰上灼烧,待跟火焰颜色相同时蘸取待测液,在火焰上灼烧,并透过蓝色Co玻璃来观察火焰的颜色。若呈现紫色,就证明含有K+。(2)铬铁矿粉碎后加入NaOH、Na2CO3等碱性物质,SiO2、Al2O3发生反应变为Na2SiO3、AlO2-。当调节溶液的pH在7~8时,就转化为H2SiO3、Al(OH)3沉淀。因此步骤③被沉淀的离子为SiO32-、AlO2-;(3)在反应器①中,二氧化硅与纯碱反应的化学方程式为:Na2CO3+SiO2  Na2SiO3+CO2↑。(4)CH3OH、H2的燃烧的热化学方程式为:①
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.5 kJ/mol ; ②H2(g)+
1/2O2(g)=H2O(l) ΔH=-285.8
kJ/mol. ②×3-①。整理可得CO2(g)+3H2(g) = CH3OH(l)+H2O(l) ΔH=-131.9 kJ/mol;(5)①根据电子守恒、电荷守恒及质量守恒定律可得电解含Cr2O72-的酸性废水的总反应的离子方程式为:6Fe+Cr2O72-+2H++17H2O
= 6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;②若地表水铬含量最高限值是0.1 mg/L ,c(Cr3+)
=1×10-4g÷52g/mol/L=
Na2SiO3+CO2↑。(4)CH3OH、H2的燃烧的热化学方程式为:①
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.5 kJ/mol ; ②H2(g)+
1/2O2(g)=H2O(l) ΔH=-285.8
kJ/mol. ②×3-①。整理可得CO2(g)+3H2(g) = CH3OH(l)+H2O(l) ΔH=-131.9 kJ/mol;(5)①根据电子守恒、电荷守恒及质量守恒定律可得电解含Cr2O72-的酸性废水的总反应的离子方程式为:6Fe+Cr2O72-+2H++17H2O
= 6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;②若地表水铬含量最高限值是0.1 mg/L ,c(Cr3+)
=1×10-4g÷52g/mol/L=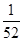 ×10-4 mol/L .Cr(OH)3的Ksp=6.3×10–31,即c(Cr3+)·c3(OH-)≥6.3×10–31;
×10-4 mol/L .Cr(OH)3的Ksp=6.3×10–31,即c(Cr3+)·c3(OH-)≥6.3×10–31;
c3(OH-)≥6.3×10–31÷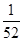 ×10-4=6.3×52×10-27.所以c(OH-)=
×10-4=6.3×52×10-27.所以c(OH-)=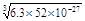 .
.
考点:考查离子的检验、沉淀;化学方程式、热化学方程式的书写;沉淀除去杂质离子时溶液的pH的计算。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀 HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀| 294×c×V×V2 |
| 6×1000×V1×m |
| 294×c×V×V2 |
| 6×1000×V1×m |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 加热 |
| ||
| ||
| 294×c×V×V2 |
| 6×1000×V1×m |
| 294×c×V×V2 |
| 6×1000×V1×m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
| 294×c×V×V2 |
| 6×1000×V1×m |
| 294×c×V×V2 |
| 6×1000×V1×m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com