
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.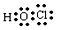 .
.分析 均为短周期元素,M为非金属元素,其气态氢化物的水溶液呈碱性,则M为N元素;A的单质与冷水剧烈反应,得到强碱性溶液,可知A为Na;B的原子最外层电子数是内层电子数的三倍,B为O;在第三周期中,C的简单离子半径最小,C为Al;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl;所有有机物中都含有E元素,则E为C,以此来解答.
解答 解:由上述分析可知,M为N,A为Na,B为O,C为Al,D为Cl,E为C,
(1)B在周期表中的位置为第二周期第VIA族,C离子的结构示意图为 ,故答案为:第二周期第VIA族;
,故答案为:第二周期第VIA族; ;
;
(2)D的最低价含氧酸为HClO,其电子式为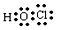 ,故答案为:
,故答案为: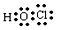 ;
;
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),负极上氨气失去电子,则负极反应方程式为2NH3-6e-+6OH-═N2+6H2O,
故答案为:2NH3-6e-+6OH-═N2+6H2O;
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,该物质为C,由质量守恒定律可知反应为4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C,故答案为:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
(5)由A、B、E组成的一种生活中的常用盐为碳酸钠或碳酸氢钠,碳酸氢钠中A的质量分数为27%,由A的质量分数为43%,可知该盐为碳酸钠,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-,故答案为:CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、元素化合物知识等来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
某温度下CH3COOH和 NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.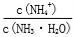 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
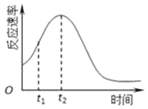 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 操作 | 现象 | 结论 | |
| A | 将含酚酞的Na2CO3溶液与BaCl2溶液混合 | 红色变浅 | Na2CO3溶液中存在水解平衡 |
| B | 将Cl2通入I2淀粉溶液中 | 溶液蓝色褪去 | Cl2有漂白性 |
| C | 向含等浓度的NaCl和KI溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 试管中加入少量淀粉和稀硫酸,冷却后加入NaOH溶液中和至碱性,再加入碘水 | 溶液未变蓝 | 淀粉己完全水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com