
����Ŀ�������������ڹ�ũҵ�����ж�����ҪӦ�á�
(1)������(N2H4)����������ĵ��⻯�
��֪��4NH3(g)��3O2(g)![]() 2N2(g)��6H2O(g)����H1����541��8 kJ��mol��1����ѧƽ�ⳣ��ΪK1��N2H4(g)��O2(g)
2N2(g)��6H2O(g)����H1����541��8 kJ��mol��1����ѧƽ�ⳣ��ΪK1��N2H4(g)��O2(g)![]() N2(g)��2H2O(g)����H2����534 kJ��mol��1����ѧƽ�ⳣ��ΪK2������NH3��O2��ȡN2H4���Ȼ�ѧ����ʽΪ__________________���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(��K1��K2��ʾ)��
N2(g)��2H2O(g)����H2����534 kJ��mol��1����ѧƽ�ⳣ��ΪK2������NH3��O2��ȡN2H4���Ȼ�ѧ����ʽΪ__________________���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(��K1��K2��ʾ)��
(2)����2NO(g)��2CO(g)![]() N2(g)��2CO2(g)����һ���¶��£���1 L�ĺ����ܱ������г���0��1 mol NO��0��3 mol CO����Ӧ��ʼ���С�
N2(g)��2CO2(g)����һ���¶��£���1 L�ĺ����ܱ������г���0��1 mol NO��0��3 mol CO����Ӧ��ʼ���С�
��������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����______(����ĸ����)��
A��c(CO)��c(CO2)
B�������л��������ܶȲ���
C��v(N2)����2v(NO)��
D�������л�������ƽ��Ħ����������
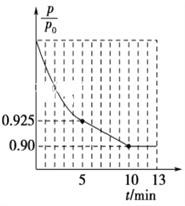
��ͼ1Ϊ�����ڵ�ѹǿ(p)����ʼѹǿ(p0)�ı�ֵ![]() ��ʱ��(t)�ı仯���ߡ�0��5min�ڣ��÷�Ӧ��ƽ����Ӧ����v(N2)��________��ƽ��ʱNO��ת����Ϊ________��
��ʱ��(t)�ı仯���ߡ�0��5min�ڣ��÷�Ӧ��ƽ����Ӧ����v(N2)��________��ƽ��ʱNO��ת����Ϊ________��
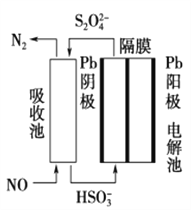
(3)ʹ�ü�ӵ绯ѧ���ɴ���ȼ�������е�NO��װ����ͼ��ʾ����֪���ص�����������Һ��pH��4��7֮�䣬д�������ĵ缫��Ӧʽ��____________________�������ӷ���ʽ��ʾ���ճ��г�ȥNO��ԭ��____________________________________________��
���𰸡� 4NH3(g)��O2(g)2N2H4(g)��2H2O(g)��H����526.2 kJ��mol��1 K1/K22 D 0��006 mol��L��1��min��1 80% 2HSO3-��2e����2H��===S2O42-��2H2O 2NO��2S2O42-��2H2O===N2��4HSO3-
��������(1)��4NH3(g)��3O2(g) ![]() 2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1����N2H4(g)��O2(g)
2N2(g)��6H2O(g) ��H1=��541.8kJ/mol����ѧƽ�ⳣ��ΪK1����N2H4(g)��O2(g) ![]() N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2�����ݸ�˹���ɣ�����-����2�ã�4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=(��541.8kJ/mol)-(��534kJ/mol)��2=��526.2kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
N2(g)��2H2O(g) ��H2=��534kJ/mol����ѧƽ�ⳣ��ΪK2�����ݸ�˹���ɣ�����-����2�ã�4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=(��541.8kJ/mol)-(��534kJ/mol)��2=��526.2kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() ���ʴ�Ϊ��4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=��526.2kJ/mol��
���ʴ�Ϊ��4NH3(g)��O2(g) = 2N2H4(g)��2H2O(g) ��H=��526.2kJ/mol�� ![]() ��
��
(2)����2NO(g)��2CO(g) ![]() N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
N2(g)��2CO2(g)����һ���¶��£���1L�ĺ����ܱ������г���0.1molNO��0.3molCO����Ӧ��ʼ���С�
��A��c(CO)=c(CO2)������ʾŨ�ȱ仯�������ж��Ƿ�Ϊƽ��״̬����A����B����Ӧ��������������䣬������䣬�����л��������ܶ�ʼ�ղ��䣬�����ж��Ƿ�Ϊƽ��״̬����B����C��v(N2)��=2v(NO)����ʾ��Ӧ����2v(N2)��=v(NO)�����ű�ʾ���淴Ӧ������ȣ���C����D���÷�Ӧ������������ʵ��������仯�ķ�Ӧ�������л�������ƽ��Ħ����������ʱ��ʾ��������ʵ������䣬 ˵����ƽ��״̬����D��ȷ����ѡD��
�����������ڵ�ѹǿ(P)����ʼѹǿ(P0)�ı�ֵ(P/P0)��ʱ��(t)�ı仯���ߣ�0��5min�ڣ�![]() =0.925�����ݰ���٤�����ɼ������ۣ�
=0.925�����ݰ���٤�����ɼ������ۣ�![]() =0.925��ƽ��ʱ
=0.925��ƽ��ʱ![]() =0.90��
=0.90��
2NO(g)�� 2CO(g) ![]() N2(g)��2CO2(g)
N2(g)��2CO2(g)
��ʼ(mol) 0.1 0.3 0 0
��Ӧ 2x 2x x 2x
5min��ƽ�� 0.1-2x 0.3-2x x 2x
5minʱ��![]() =0.925�����x=0.03mol��v(N2)=
=0.925�����x=0.03mol��v(N2)=![]() = 0.006mol��L��1��min��1��ƽ��ʱ��
= 0.006mol��L��1��min��1��ƽ��ʱ��![]() =0.90�����x=0.04mol��NO��ת����=
=0.90�����x=0.04mol��NO��ת����=![]() ��100%=80%���ʴ�Ϊ��0.006 mol��L��1��min��1��80%��
��100%=80%���ʴ�Ϊ��0.006 mol��L��1��min��1��80%��
(3)����������ԭ��Ӧ����������������ӣ��õ��ӣ����������������ӣ��缫��ӦʽΪ��2HSO3-+2e-+2H+�TS2O42-+2H2O����������������һ����������������ԭ��Ӧ�����ɵ��������ӷ�Ӧ����ʽΪ��2NO+2S2O42-+2H2O�TN2+4HSO3-���ʴ�Ϊ��2HSO3-+2H++2e-=S2O42-+2H2O��2NO+2S2O42-+2H2O=N2+4HSO3-��
�����͡������
��������
10
����Ŀ������ӵ����Ŀǰ������߱������Ķ��ε�ء�LiFePO4�ɼ���ظ��Ƶ����ϵ�İ�ȫ���ܣ��Ҿ�����Դ�ḻ��ѭ���������������Ѻõ��ص㣬������ӵ���������ϵ�����ѡ������LiFePO4��һ�ֹ���������ͼ��
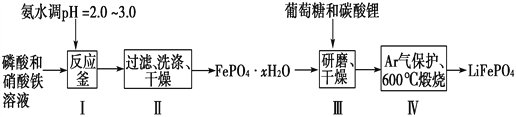
��֪��Ksp(FePO4��xH2O)��1.0��10��15��Ksp[Fe(OH)3]��4.0��10��38��
(1)�ںϳ�������ʱ���������pH�Ŀ����ǹؼ������pH<1.9��Fe3����������ȫ��Ӱ����������pH��3.0������ܴ��ڵ�������________________��
(2)������У�ϴ����Ϊ�˳�ȥFePO4��xH2O���渽�ŵ�________�����ӡ�
(3)ȡ3��FePO4��xH2O��Ʒ���������³�����ղ���ᾧˮ������ʵ���������±���
ʵ����� | 1 | 2 | 3 |
����ʧ���������� | 19.9% | 20.1% | 20.0% |
����ʧ������������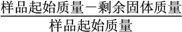 ��100%����x��_______(��ȷ��0.1)��
��100%����x��_______(��ȷ��0.1)��
(4)���������ĥ��������__________________________________��
(5)�ڲ������������LiFePO4��CO2��H2O�����������뻹ԭ�������ʵ���֮��Ϊ________��
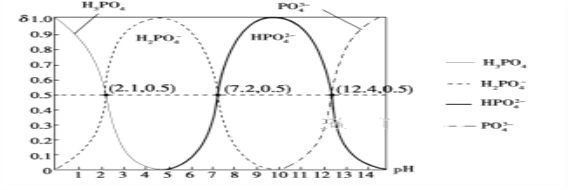
(6)H3PO4����Ԫ�ᣬ��ͼ�dz�������Һ�к����������ʵ�������(��)��pH�仯ʾ��ͼ����PO![]() ��һ��ˮ���ˮ�ⳣ��K1�ı���ʽΪ______��K1����ֵ��ӽ�______(����ĸ)��
��һ��ˮ���ˮ�ⳣ��K1�ı���ʽΪ______��K1����ֵ��ӽ�______(����ĸ)��
A��10��12.4����B��10��1.6 C��10��7.2 D��10��4.2
���𰸡� ����Fe(OH)3���ʣ�Ӱ���������Ĵ��� NO![]() ��NH
��NH![]() ��H��(ֻҪд��NO
��H��(ֻҪд��NO![]() ��NH
��NH![]() ����) 2.1 ʹ��Ӧ���Ͼ��ȣ�����Ӧ���ʣ���߷�Ӧ����(�𰸺�������) 24��1
����) 2.1 ʹ��Ӧ���Ͼ��ȣ�����Ӧ���ʣ���߷�Ӧ����(�𰸺�������) 24��1 ![]() B
B
���������������������Һ�м��백ˮ������ҺpHֵ2-3Ŀ�������������������ˡ�ϴ�ӡ�����õ�FePO4��xH2O�����������Ǻ��������ĥ���������������װ���и������յõ�LiFePO4����1������I��pH�Ŀ����ǹؼ������pH��1.9��Fe3����������ȫ��Ӱ����������pH��3.0������ܴ��ڵ������ǣ�����Fe(OH)3���ʣ�Ӱ���������Ĵ��ȣ���2������II�У�ϴ����Ϊ�˳�ȥFePO4��xH2O���渽�ŵ�NO3����NH4����H������3��ͼ���й���ʧ������������ƽ��ֵ=��19.9%+20.1%+20.0%��/3=20.0%��![]() ,x=2.1������4������III����ĥ������ʹ��Ӧ���Ͼ��ȣ�����Ӧ���ʣ���߷�Ӧ����(�𰸺�������) ����5���ڲ���IV��������LiFePO4��CO2��H2O����Ӧ�Ļ�ѧ����ʽΪ��24FePO4+C6H12O6+12Li2CO3=24LiFePO4+18CO2+6H2O�����������뻹ԭ�������ʵ���֮��Ϊ24��1����6��H3PO4����Ԫ�ᣬ��PO42����һ��ˮ������ӷ���ʽΪ��PO43��+H2O
,x=2.1������4������III����ĥ������ʹ��Ӧ���Ͼ��ȣ�����Ӧ���ʣ���߷�Ӧ����(�𰸺�������) ����5���ڲ���IV��������LiFePO4��CO2��H2O����Ӧ�Ļ�ѧ����ʽΪ��24FePO4+C6H12O6+12Li2CO3=24LiFePO4+18CO2+6H2O�����������뻹ԭ�������ʵ���֮��Ϊ24��1����6��H3PO4����Ԫ�ᣬ��PO42����һ��ˮ������ӷ���ʽΪ��PO43��+H2O![]() HPO42��+OH����ˮ�ⳣ��K1�ı���ʽ=c(OH��)c(HPO42��)/c(PO43��)��ͼ���п�֪c��PO43����=c��HPO42����ʱ��pH=12.4����c��OH����=10-14/10-12.4=10-1.6mol��L��1����ѡB��
HPO42��+OH����ˮ�ⳣ��K1�ı���ʽ=c(OH��)c(HPO42��)/c(PO43��)��ͼ���п�֪c��PO43����=c��HPO42����ʱ��pH=12.4����c��OH����=10-14/10-12.4=10-1.6mol��L��1����ѡB��


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д� ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.25 gmL��1����������Ϊ36.5%��Ũ��������240 mL 0.1 molL��1�����ᣬ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ________________________��
��2������240 mL 0.1 molL��1������
Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
__________ | __________ |
��3������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ�__________��
A����30 mLˮϴ���ձ��ڱںͲ�����23�Σ�ϴ��Һ��ע������ƿ����
B������Ͳ��ȷ��ȡ�����Ũ���������������ձ��У��ټ�������ˮ��Լ30 mL�����ò���������������ʹ���Ͼ���
C��������ȴ�������ز�����ע������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���12 cm��
��4����ʵ�������������������������������ʵ���Ũ���к�Ӱ�죨�ƫ�ߡ���ƫ�͡����䡱��
������ϡ��������ձ�δϴ��__________________________________________��
������ƿ��ԭ����������ˮ____________________________________________��
�۶���ʱ���ӹ۲�Һ��________________________________________________��
��5����ʵ������г������������δ�����
�ٶ���ʱ������ˮʱ�����˿̶�________________________________________��
��������ƿ��ת����Һʱ��������Һ����________________________________��
�۶���ҡ�Ⱥ���Һ���½�____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������е�����������( )
A.0.6 mol��L1������
B.0.1 mol��L1������
C.���ڵ�NaCl
D.����ؾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ�����ݻ�������ܱ�������ע��NO2���壬2NO2��g��N2O4��g����H��0��ƽ���Ѹ��������ڷ�ˮ�У��������ʻ���ֵ����ı����( )
����ɫ ��ƽ��Ħ������ ������ ��ѹǿ ���ܶȣ�
A���٢� B���ڢ� C���ܢ� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʪ��Cl2ͨ����װ�ú���ͨ�����и����ɫ������ ��װ�ã���ɫ��������ɫ�����װ������ʢ�Լ�������

��Ũ���� �ڱ���ʳ��ˮ ��ˮ ��NaOH��Һ
A. �٢� B. �ڢ� C. �٢� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��OH��3�����MgCl2��Һ��ͬ�߱��������ǣ�������
A.���߾��ж��������
B.���߾�������Ĥ
C.���������ȳ���������ܽ�
D.��ɢ������ͨ����ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.100molL-1������ζ�10ml0.100molL-1��Na2CO3��Һ����ҺpHֵ��������������Ĺ�ϵ��ͼ��ʾ����֪����ʱ����CO2��pHΪ3.9��0.05molL-1NaHCO3��pHԼΪ8.3������˵������ȷ���ǡ�
��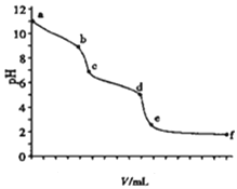
A. �Է�̪Ϊָʾ������Һ��ɫ����ͻ��ʱ��b�㣩��Na2CO3ת��ΪNaHCO3
B. �Լ���Ϊָʾ������Һ��ɫ����ͻ��ʱ������������20.00ml
C. ��ҺpH=7��c�㣩��̼������ȫת��ΪNaCl
D. ce�ζ�Ӧ��Һ��CO2��NaHCO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ���п�������ᷴӦ��ȡH2�����д�ʩ������߸÷�Ӧ��Ӧ���ʵ���
A.��ˮ������ϡ��B.��п�۴���п��
C.�ʵ��������Ũ��D.��ӦҺ�е�������CuCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǰ��ʳ�۸�IJ���������ǰ����������Ҵ����ƹ���ʳ���������Ҵ����ʹ���һ������ϵ�������Ҵ����������Ҵ������Ͱ�һ��������϶��ɵġ�����˵���в���ȷ����
A.��������ʯ��Ϊԭ�ϼӹ����ɵ�
B.�Ҵ���������ʳ�еĵ���ת������
C.�ƹ㳵���Ҵ����Ϳɽ�ʡʯ����Դ�����������Ⱦ�����ƴ�������
D.�Ҵ���һ�ֲ���������Դ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com