
| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子1100℃ | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |
分析 A、溶液体积不明确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、求出氖气的物质的量,然后根据氖气为单原子分子来分析;
D、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所得的氢氧化铁胶粒的个数小于0.1NA个,故B错误;
C、标况下11.2L氖气的物质的量为0.5mol,而氖气为单原子分子,故0.5mol氖气中含0.5NA个氦原子,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含0.1NA个阴离子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:选择题
| A. | 往溶液中滴入0.2 mol•L-1的氨水 | B. | 往溶液中加入NH4Cl晶体 | ||
| C. | 往溶液中加入CH3COONa固体 | D. | 往溶液中加入NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA | |
| B. | 3.9g Na2O2晶体中含有0.2NA个离子 | |
| C. | 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 3mol H2和1mol N2在一定条件下反应所得混合气体分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
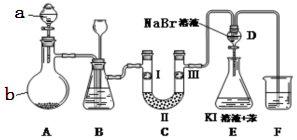
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti3+,形成配位键时提供电子对 | |
| C. | 配离子是[TiCl(H2O)5]2+,内界和外界中的Cl-的数目比是1:2 | |
| D. | 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,生成AgCl沉淀3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=1时,发生的离子反应为:OH-+H+═H2O | |
| B. | 当a=2时,发生的离子反应为:OH-+CO32-+2H+═HCO3-+H2O | |
| C. | 当1<a<2,反应后的溶液中CO32-和HCO3-的物质的量之比为:(a×10-2-0.01):(0.02-a×10-2) | |
| D. | 当a≥3时,发生的离子反应:3H++OHˉ+CO32-═2H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂 | |
| B. | 高炉炼铁得到纯度高的铁,加入其他金属炼制得到钢 | |
| C. | 焙制糕点的发酵粉主要成分之一是碳酸氢钠,它也是治疗胃酸过多的一种药剂 | |
| D. | 分子筛常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.
如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com