
| A. | x的值为4 | B. | A的转化率为60% | ||
| C. | B的平衡浓度为0.8 mol/L | D. | D的体积分数为20% |
分析 在2L密闭容器中,把1mol A和1mol B混合,反应达到平衡时,生成0.4mol D,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):1 1 0 0
变化量(mol):0.6 0.2 0.2x 0.4
平衡量(mol):0.4 0.8 0.2x 0.4
A.结合C的平衡浓度为0.4mol/L计算x的值;
B.转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
C.根据c=$\frac{n}{V}$计算平衡时B的浓度;
D.D的体积分数=$\frac{D的物质的量}{混合气体总物质的量}$.
解答 解:在2L密闭容器中,把1mol A和1mol B混合,反应达到平衡时,生成0.4mol D,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):1 1 0 0
变化量(mol):0.6 0.2 0.2x 0.4
平衡量(mol):0.4 0.8 0.2x 0.4
A.0.2x=0.4mol/L×2L,则x=4,故A正确;
B.A的转化率=$\frac{0.6mol}{1mol}$×100%=60%,故B正确;
C.平衡时B的浓度为$\frac{0.8mol}{2L}$=0.4mol/L,故C错误;
D.D的体积分数=$\frac{0.4mol}{2.4mol}$=16.67%,故D错误,
故选:CD.
点评 本题考查化学平衡计算,比较基础,注意三段式解题法在化学平衡计算中应用.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有的盐电离时只能生成酸根阴离子和金属阳离子 | |
| B. | 只由一种分子组成的物质一定为纯净物,组成混合物的物质可能只有一种元素 | |
| C. | 氧化物是指含有氧元素的化合物,如NaOH、H2SO4等 | |
| D. | 氨气溶于水溶液显碱性,所以氨气属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

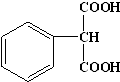 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液混合:H++$S{{O}_{4}}^{2-}$+Ba2++OH-═BaSO4↓+H2O | |
| B. | 向明矾中滴加少量Ba(OH)2溶液:2Al3++3S${{O}_{4}}^{2-}$+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Fe(OH)3胶体的制备:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═$N{{H}_{4}}^{+}$+HS${{O}_{3}}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
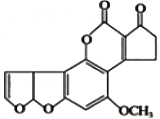 目前,我国有不法商贩用地沟油牟取暴利.医学研究证明,地沟油中的黄曲霉素强烈致癌.已知一种黄曲霉素的结构简式如图所示,关于该分子的说法中正确的是
目前,我国有不法商贩用地沟油牟取暴利.医学研究证明,地沟油中的黄曲霉素强烈致癌.已知一种黄曲霉素的结构简式如图所示,关于该分子的说法中正确的是| A. | 1个分子中共含有30个δ键 | B. | 有5个碳原子采用sp3杂化 | ||
| C. | 属于极性分子,易溶于水 | D. | 分子中所有原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2的催化氧化是工业上生产硫酸的关键步骤.
SO2的催化氧化是工业上生产硫酸的关键步骤.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2mol C | |
| B. | 2mol A、1mol B和1mol He(不参加反应) | |
| C. | 1mol B和1mol C | |
| D. | 2mol A、3mol B和3mol C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com