
【题目】(1)t1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为___。
②5~6min时间段内,平衡移动方向为___(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是___(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度
c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度___c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:

①用CO还原FeO制备Fe的反应是___(填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2___T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图2所示。
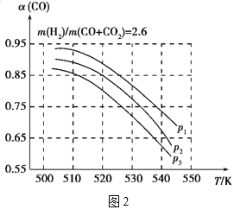
图中的压强由大到小的顺序为___,判断理由是___;试解释CO平衡转化率随温度升高而减小的原因是___。
【答案】3~4 min 向右移动 a > 放热 > p1>p2>p3 相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率 反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小
【解析】
⑴①从表格中数据分析,体系中各物质的浓度不再变化的时间就为达到平衡状态;根据数据看出H2O(g)的浓度增大,CO的浓度减小,说明是增加了H2O(g)的量;反应的正反应为放热反应,升高温度,平衡逆向移动,CO转化率减小。
⑵升高温度,化学平衡常数增大,正反应为吸热反应,则其逆反应为放热反应,计算T2的K值,与T1的K值比较,得出温度关系。
⑶由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化;反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小。
⑴①从表格中数据分析,第3~4 min时,体系中各物质的浓度不再变化,说明反应已经达到平衡状态,故答案为:3~4 min。
②5~6min时间段内,H2O(g)的浓度增大,CO的浓度减小,说明是增加了H2O(g)的量,使平衡正向移动,故答案为:向右移动;a。
③该反应的正反应为放热反应,升高温度,平衡逆向移动,CO转化率减小,则t2℃反应达到平衡时,CO浓度 > c1,故答案为:>。
⑵①由题图1可知,升高温度,化学平衡常数增大,说明Fe(s)+CO2(g)![]() FeO(s)+CO(g)为吸热反应,则其逆反应为放热反应,故答案为:放热。
FeO(s)+CO(g)为吸热反应,则其逆反应为放热反应,故答案为:放热。
②K(T2)=c(CO)/c(CO2)=2.5 > K(T1),根据图像信息可知,K越大,对应的温度越高,所以T2>T1,故答案为:>。
⑶反应①是体积减小的反应,反应②是等体积反应,从上到下,转化率增长,说明是增大压强,因此压强由大到小的顺序为p1>p2>p3,判断理由是相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率,CO平衡转化率随温度升高而减小的原因应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小,故答案为:p1>p2>p3;相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率;反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小。


科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应方程式如下: CH3COO[Cu(NH3)2]+CO+NH3=CH3COO[Cu(NH3)3CO]。
(1)Cu+基态核外电子排布式为_____________________。
(2)C、N、O元素的第一电离能由大到小的顺序为_____________________。
(3)1mol[Cu(NH3)2]+中含有σ键的数目为___________,CH3COO[Cu(NH3)2]中C原子轨道的杂化类型是_______________。
(4)与NH3分子互为等电子体的阴离子为______________。
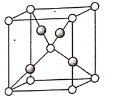
(5)Cu2O的晶胞结构如图所示,其中O2-的配位数是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛又名香兰素,是食品和药品的重要原料,其结构简式如图所示。下列有关香草醛的说法中不正确的是( )

A.香草醛可以发生银镜反应
B.在一定条件下1mol香草醛可以与4molH2反应
C.香草醛遇FeCl3溶液可变色
D.香草醛可与NaOH溶液反应,也可与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热蒸干氯化镁溶液时因水解不完全会得到一种灰白色沉淀——碱式氯化镁,化学式可表示为Mgx(OH)yClz·nH2O,设计如图装置验证其化学式。下列有关实验的说法不正确的是( )
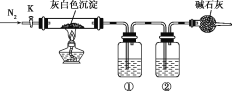
A.碱式氯化镁受热分解可以生成氧化镁、氯气和水
B.结束反应时,先停止加热,通一段时间N2后再关闭活塞K
C.①②中依次盛装浓硫酸、氢氧化钠溶液
D.只需称量原样品质量、反应结束后硬质玻璃管中剩余固体质量以及装置①增重的质量即可推出其化学式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是( )
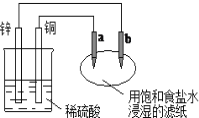
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐的形式存在,可用电解法从溶液中除去。有Cl-存在时,除氮原理如图1所示,主要依靠有效氯(HClO、ClO-)将NH4+或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度与溶液pH的关系如图2所示。

下列说法不正确的是( )
A.pH=3时,主要发生ClO-氧化NH3的反应
B.pH>8时,有效氯浓度随pH的增大而减小
C.pH>8时,NH4+转变为NH3H2O,且有利于NH3逸出
D.pH<8时,氮的去除率随pH的减小而下降的原因是c(HClO)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、科技密切相关,下列有关说法正确的是( )
A.硅胶的主要成分是![]()
B.华为最新一代旗舰芯片麒麟9905G中半导体材料为二氧化硅
C.燃放烟花呈现出多种颜色是由于烟花中添加了![]() 、
、![]() 、
、![]() 、
、![]() 等金属的单质
等金属的单质
D.“钻酞菁”(分子直径为![]() )在水中形成的分散系能产生丁达尔效应
)在水中形成的分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_____________、B___________、C______________、F_____________、 H____________、乙______________
(2)写出下列反应化学方程式:
反应①_________________________________________________
反应⑤_________________________________________________
反应⑥_________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com