
【题目】下列说法不正确的是
A.氯气可用于合成药物B.SO2环境污染大,工业生产中没有价值
C.纯碱在造纸工业中有着重要的应用D.硫酸铜可作泳池池水消毒剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 用规格为10mL的量筒量取6mL的液体
B. 用药匙或者纸槽把粉末状药品送入试管底部
C. 过滤时玻璃棒的末端应轻轻的靠在三层的滤纸上
D. 如果没有试管夹,可以临时手持试管给固体或液体加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用废铁为主要原料生产黄色颜料氧化铁黄(化学式:FeOOH)的一种工艺流程如下:
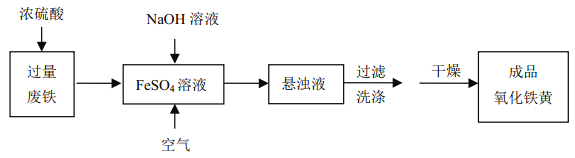
主要反应:4FeSO4+O2+8NaOH→4FeOOH↓+4Na2SO4+2H2O,完成下列填空:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为___________________,钢铁的电化学保护有一种是外加电流阴极保护法,另一种是______________阴极保护法。
(2)废铁在反应前需清洗表面油污,请用水解平衡移动原理解释常用热的纯碱溶液清洗废铁表面油污的原因________________________________________________。
(3)FeSO4的氧化过程若温度太高会发生副反应而产生红褐色沉淀[Fe(OH)3],其离子方程式是_________________、 ___________________。
(4)检验氧化铁黄沉淀洗涤是否完全的方法是:向最后一次洗涤液中加入_______试剂,若出现_______现象则表明未洗涤完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g) ![]() 2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是
2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是

A. A点v 正(SO2) >v 逆(SO3) B. B点表示反应处于平衡状态
C. D点n(SO2)大于C点 D. 其它条件不变,升温至500℃并达平衡时,n(SO3)比图中D 点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比___________________________,分子个数比为______________,所含氧原子的个数比为__________________.
(2)在“粗盐提纯”的实验中,多次用到玻璃棒,在溶解、过滤、蒸发三个步骤中,玻璃棒所起到的作用分别是__________;_____________________;_____________________.
(3)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
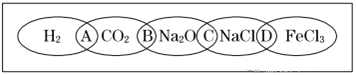
请将分类依据代号填入相应的括号内:
①(_____)两种物质都不是电解质 ② (_____)两种物质都是钠的化合物
③(_____)两种物质都是氧化物 ④(_____)两种物质都是盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为第IVA族具有可变价的金属元素,其单质沸点为2260℃。四氯化锡(SnCl4)是无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室中可用氯气与过量金属锡通过下图装置制备SnCl4 (夹持装置已略去)。
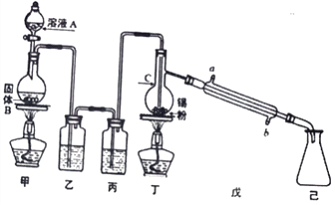
(1)仪器C的名称为___________,装置乙中的试剂是_____________。
(2)装置甲中发生反应的化学方程式为___________________________________。
(3)氯气与锡的反应类似与铁的反应,但该实验中对装置丁要持续加热,其原因是_____________。
(4)你认为该实验装置需要进行的改进是:__________________________________________。
(5)用下列方法和步骤测定所用金属锡样品的纯度(杂质不参加反应)
①将2.000g锡完全溶于过量稀盐酸中,并用所得溶液去还原过量的FeCl3稀溶液,最后得100.00mL 溶液。写出第二步反应的离子方程式:_____________________________。
②取①所得溶液amL用0.100 mol·L-1 的K2Cr2O7溶液滴定,发生如下反应:6FeCl2+ K2Cr2O7+ 14HCl=6FeCl3+2KCl+2CrCl3+7H2O。
K2Cr2O7溶液应注入到____式(填"酸或碱”) 滴定管中。到达滴定终点时用去bmL。则样品中锡的质量分数为_______%(用含a、b 的最简代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是( )
实验方案 | 实验目的 | |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
| 制备Fe(OH)2并能较长时间观察其颜色 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.KOH═K++OH﹣ B.NaHCO3═Na++H++CO32﹣
C.H2SO4═2H++SO42﹣ D.Fe2(SO4)3═Fe23++3SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)

(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯(填“A”或“B”),装置中电子的移动路径和方向为___________________________。
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(2)该小组的一位成员认为溶液中的阴阳离子能通过铜导线从而构成闭合回路形成电流,该装置仍然为原电池。你对该观点的评价是_________(填“正确”或“不正确”)。
(3)对于实验中产生电流的原因,该小组进行了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池。那么在烧杯B中铜片上发生反应的电极反应式为______________________。
(4)对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的正极反应式为:_________________________________。
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的正极反应式为:_________________ 。
(5)若第(4)问中②观点正确,则可以利用此原理设计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com