
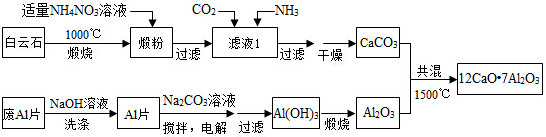
分析 白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙,
(1)锻粉是由白云石高温煅烧而来;用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp来计算;CaSO4微溶于水;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,据此分析产物;
(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水;
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,据此分析;
(5)放电时负极电极本身Al放电,失电子,根据AlCl4-和Al2Cl7-中铝元素和氯元素的比例来确定做AlCl4-做反应物而生成Al2Cl7-.
解答 解:白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙,
(1)锻粉是由白云石高温煅烧而来,在煅烧白云石时,发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,故所得锻粉主要含MgO和CaO;用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp可知:Ksp=c(Mg2+)•c2(OH-)=5×10-12,而c(Mg2+)小于5×10-6mol•L-1,故c(OH-)大于10-3mol/L,则溶液中的c(H+)小于10-11mol/L,溶液的pH大于11;CaSO4微溶于水,如果用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失,
故答案为:CaO;11;CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失;
(2)在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,故滤液中的阴离子主要为NO3-,还含有OH-;若滤液Ⅰ中仅通入CO2,会造成CO2过量,则会生成Ca(HCO3)2,从而导致CaCO3产率降低,故答案为:NO3-、OH-;Ca(HCO3)2;
(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,石墨做阴极,阳极反应为:Al-3e-=Al3+①,阴极上是来自于水的H+放电:2H2O+2e-=2OH-+H2↑ ②
将①×2+②×3可得总反应:2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑,故答案为:2Al+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑;
(5)放电时负极电极本身Al放电,失电子,由于AlCl4-中氯元素的含量高于Al2Cl7-中氯元素的含量,故AlCl4-做反应物而Al2Cl7-为生成物,由于其它离子不参与电极反应,故电极反应为:Al-3e-+7AlCl4-=4Al2Cl7-,故答案为:Al-3e-+7AlCl4-=4Al2Cl7-.
点评 本题综合考查物质的制备以及分离提纯、难溶电解质的溶解平衡等,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及题目给予的信息,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、CO32-、Cl- | B. | Ca2+、K+、CO32-、OH- | ||
| C. | Fe3+、Ba2+、NO3-、SO42- | D. | H+、Na+、Cu2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 升高温度 | D. | 加入少量氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,水的电离程度:①>② | |
| B. | 分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② | |
| C. | 等体积的①、②溶液分别与足量铝粉反应,生成H2的质量:①=② | |
| D. | 将等体积的①、②溶液中分别稀释10倍后,溶液的pH:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
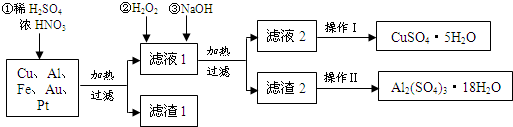

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
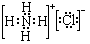 ;②B溶于水的过程中存在的可逆反应式为NH3+H2O
;②B溶于水的过程中存在的可逆反应式为NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com