
| 体积 | ||||
| 反应温度/℃ | 0.1mol?L-1Na2S2O3 | 0.1mol?L-1H2SO4 | H2O | |
| A | 10 | 10 | 10 | 0 |
| B | 10 | 9 | 10 | V1 |
| C | 50 | 8 | 10 | V2 |
| 实验步骤 | 预期现象及结论 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是氢的一种同素异形体 |
| B、是氢的一种新的同位素 |
| C、它的组成可用H3+表示 |
| D、它比一个普通H2分子多一个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 杂质 | 加入试剂 | 化学方程式 |
| Na2SO4 | ||
| MgCl2 | ||
| CaCl2 | ||
| - | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |

查看答案和解析>>
科目:高中化学 来源: 题型:
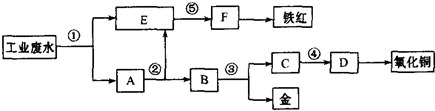
查看答案和解析>>
科目:高中化学 来源: 题型:
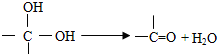
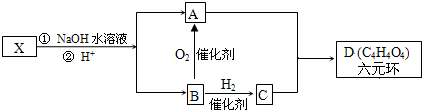
| 浓硫酸 |
| ℃170 |
| 高温、高压 |
| 催化剂 |
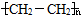 .
.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com