
| A. | 聚乙烯、聚氯乙烯、纤维素都属于合成高分子 | |
| B. | 油脂、淀粉和蛋白质都是食物中含有的重要营养物质,一定条件下都能水解 | |
| C. | 除去乙酸乙酯中的少量乙酸,可加入氢氧化钠溶液充分反应后分液 | |
| D. | 丙烷的同分异构体共有3种 |
分析 A.聚乙烯、聚氯乙烯利用加聚反应生成,而纤维素为天然高分子;
B.油脂含-COOC-、淀粉为多糖、蛋白质含-CONH-;
C.乙酸乙酯、乙酸均与NaOH反应;
D.丙烷的结构只有一种.
解答 解:A.聚乙烯、聚氯乙烯利用加聚反应生成,而纤维素为天然高分子,则聚乙烯、聚氯乙烯都属于合成高分子,故A错误;
B.油脂含-COOC-、淀粉为多糖、蛋白质含-CONH-,则均能发生水解反应,且都是食物中含有的重要营养物质,故B正确;
C.乙酸乙酯、乙酸均与NaOH反应,不能除杂,应选饱和碳酸钠溶液、分液,故C错误;
D.丙烷的结构只有一种,则不存在同分异构体,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的组成、分离提纯等为解答的关键,侧重分析与应用能力的考查,注意烷烃中从丁烷开始出现同分异构体,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
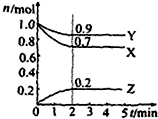 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③⑤⑦ | C. | ①④⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的一氯代物只有一种 | ||
| C. | 苯的二氯代物只有三种 | D. | 苯分子中六个碳碳键键长完全相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和二氧化硅都属于原子晶体 | |
| B. | 分子晶体的状态变化,只需克服分子间作用力 | |
| C. | 金属晶体通常具有导电、导热性能和良好的延展性 | |
| D. | 离子晶体在熔化状态下能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 240 | 250 | 260 | 270 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡气体总浓度/ mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
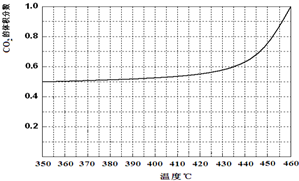
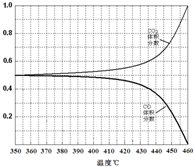 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
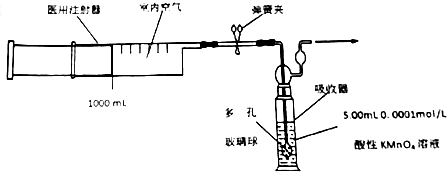
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X-衍射实验可以区分晶体和非晶体 | B. | SiO2属于原子晶体 | ||
| C. | 金属钋是简单立方堆积 | D. | 晶格能的大小只与离子半径有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com