
【题目】目前我国的新冠肺炎防疫工作已取得了阶段性胜利,疫情中心武汉市已于4月8日零时解封。在国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中,抗病毒治疗试用药物增加了磷酸氯喹。磷酸氯喹可由氯喹和磷酸在一定条件下制得。氯喹(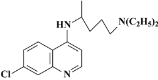 )可由以下路线合成:
)可由以下路线合成:
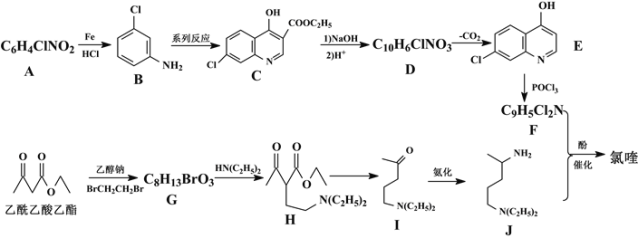
回答下列问题:
(1)A的名称为___,G中含氧官能团的名称为___,G→H的反应类型为___。
(2)写出F+J→氯喹的化学反应方程式___。
(3)有机物B与足量H2加成后的产物为X,试用“*”标出X中的手性碳原子___。
(4)M与H互为同分异构体,符合下列条件的M有___种。其中核磁共振氢谱中显示有7个吸收峰,峰面积比为6:4:4:4:3:1:1,其结构简式为___ (任写一种)。
①含有六元环和-N(C2H5)2②酸性条件下水解产物含乙酸③能发生酯化反应
(5)参照以上合成路线,请设计以1,3-丁二烯和苯为原料合成![]() 的合成路线___。
的合成路线___。
【答案】间氯硝基苯 羰基和酯基 取代  +HCl
+HCl ![]() 19
19 ![]() 、
、![]() 或
或![]()
【解析】
A的分子式为C6H4ClNO2,A与Fe/HCl反应生成B,结合B的结构简式,A的结构简式为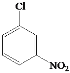 ;C与NaOH反应后酸化得到D,结合C的结构简式和D的分子式,D的结构简式为
;C与NaOH反应后酸化得到D,结合C的结构简式和D的分子式,D的结构简式为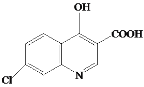 ;E与POCl3反应生成F,结合F的分子式和E的结构简式,F的结构简式为
;E与POCl3反应生成F,结合F的分子式和E的结构简式,F的结构简式为 ;乙酰乙酸乙酯与乙醇钠、BrCH2CH2Br反应生成G,G与HN(C2H5)2反应生成H,结合G的分子式以及H的结构简式,G的结构简式为
;乙酰乙酸乙酯与乙醇钠、BrCH2CH2Br反应生成G,G与HN(C2H5)2反应生成H,结合G的分子式以及H的结构简式,G的结构简式为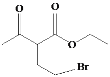 ,据此分析作答。
,据此分析作答。
(1) A的结构简式为 ,氯原子和硝基处于间位,故命名为间氯硝基苯;G的结构简式为
,氯原子和硝基处于间位,故命名为间氯硝基苯;G的结构简式为 ,其中含氧官能团为羰基和酯基;G→H的反应,通过对比两者的结构可以发现,—Br被—N(C2H5)2取代,故为取代反应;
,其中含氧官能团为羰基和酯基;G→H的反应,通过对比两者的结构可以发现,—Br被—N(C2H5)2取代,故为取代反应;
(2) F+J→氯喹的反应为取代反应,除了氯喹外还有HCl生成,反应的化学方程式为 +HCl;
+HCl;
(3)当碳原子连接的四个原子或原子团不相同时,呈镜像对称,这样的碳原子为手性碳原子,B与足量H2加成后的产物X为 ,含2个手性碳:
,含2个手性碳: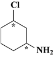 ;
;
(4)H的结构简式为 ,H的不饱和度为2,同时符合①含有六元环和-N(C2H5)2、②酸性条件下水解产物含乙酸、③能发生酯化反应的同分异构体含有的—OH、CH3COO—、—N(C2H5)2,当CH3COO—、—N(C2H5)2位于同一个碳时有3种结构,二者处于对位时有4种结构,处于间位时有6种结构,处于邻位时有6种结构,总共3+4+6+6=19种结构;其中核磁共振氢谱中显示有7个吸收峰,峰面积比为6:4:4:4:3:1:1的有
,H的不饱和度为2,同时符合①含有六元环和-N(C2H5)2、②酸性条件下水解产物含乙酸、③能发生酯化反应的同分异构体含有的—OH、CH3COO—、—N(C2H5)2,当CH3COO—、—N(C2H5)2位于同一个碳时有3种结构,二者处于对位时有4种结构,处于间位时有6种结构,处于邻位时有6种结构,总共3+4+6+6=19种结构;其中核磁共振氢谱中显示有7个吸收峰,峰面积比为6:4:4:4:3:1:1的有![]() 、
、![]() 、
、![]() ;
;
(5)以1,3-丁二烯和苯为原料合成![]() ,对于产物结合上面的合成路线可知,①需要在苯环上引入—NH2,参照A转化为B的过程,先硝化再还原,②1,3-丁二烯不完全加成变为一个双键,两步反应的产物发生类似G→H的取代反应得到目标产物,合成路线为:
,对于产物结合上面的合成路线可知,①需要在苯环上引入—NH2,参照A转化为B的过程,先硝化再还原,②1,3-丁二烯不完全加成变为一个双键,两步反应的产物发生类似G→H的取代反应得到目标产物,合成路线为: 。
。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
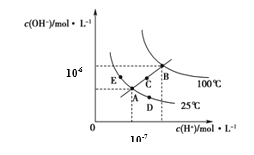
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
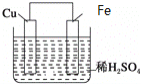
①Fe为正极,Cu为负极;②H+向铁电极移动;③电子是由Fe经外电路流向Cu;④内电路电流由铁电极流向铜电极;⑤若有1mol电子流过导线,则产生的![]() 为
为![]() ;⑥负极的电极反应式为
;⑥负极的电极反应式为![]() 。
。
A.③④B.③⑤C.③④⑤D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。

(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是( )
A.草木灰与铵态氮肥不能混合施用与盐类水解有关
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
D.生活中Cl2和NaOH制取消毒液,运用了盐类的水解原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7。主要流程如图:

(1)加入适量Na2S溶液后生成的沉淀X为___,若加入的Na2S溶液过量,除生成X外还会发生反应的离子方程式为___。
(2)请配平[Cu(NH3)4]SO4·H2O加热发生分解反应的化学方程式。
___[Cu(NH3)4]SO4·H2O![]() ___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
(3)“沉CuNH4SO3”时可用如图装置(夹持、加热仪器略):
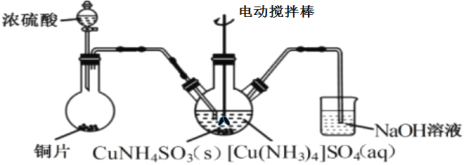
①“沉CuNH4SO3”时,反应温度需控制在45℃,合适的加热方式是___。
②NaOH溶液的作用是___。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250mL溶液,取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol/L硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行三次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为20.00mL,则所得产品K2Cr2O7的纯度为___%。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+,还含有一定浓度的Fe3+,可通过调pH的方法使两者转化为沉淀。假设两种离子初始浓度均为2×10-3mo/L,当溶液中刚开始析出Cr(OH)3沉淀时,c(Fe3+)=___mo/L。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
![]() 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用![]() 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。
已知:![]()
![]()
![]()
![]()
![]()
则![]() ______
______![]() ;
;
![]() 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应:![]()
![]()
![]() ,
,![]() 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时,![]() 的浓度为
的浓度为![]() 的2倍,回答下列问题。
的2倍,回答下列问题。
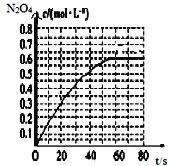
![]() 时,该反应的平衡常数为
时,该反应的平衡常数为![]() 精确到小数点后两位
精确到小数点后两位![]() ______。
______。
![]() 在温度为
在温度为![]() 、
、![]() 时,平衡体系中
时,平衡体系中![]() 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。

下列说法正确的是______
![]() 、C
、C![]()
![]() 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅
![]() 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法
![]() 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得![]() ,
,![]() ,则此时
,则此时![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
![]() 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL![]() 溶液中滴加
溶液中滴加![]() 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
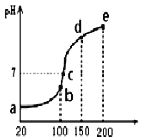
![]() 水的电离程度最大的是______;
水的电离程度最大的是______;
![]() 其溶液中
其溶液中![]() 的数值最接近
的数值最接近![]() 的电离常数K数值的是______。
的电离常数K数值的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O=H++OH-,下列叙述正确的是( )
A.![]() 表示的粒子不会对水的电离平衡产生影响
表示的粒子不会对水的电离平衡产生影响
B.![]() 表示的物质加入水中,促进水的电离,c(H+)增大
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时,CH3COO-加入水中,促进水的电离,Kw不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molCH3CH=CH2含σ键9NA
B.14.2gC10H22含共价键个数为3.2NA
C.14g乙烯和丙烯混合气体中的氢原子数为2NA
D.标准状况下,2.24LCCl4含有的CCl4分子数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com