
 .
. ;
; +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$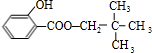 +H2O.
+H2O.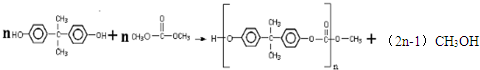 ,反应类型为缩聚反应.
,反应类型为缩聚反应.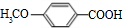 .
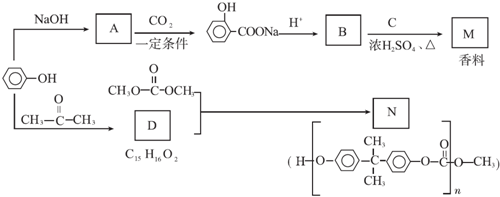
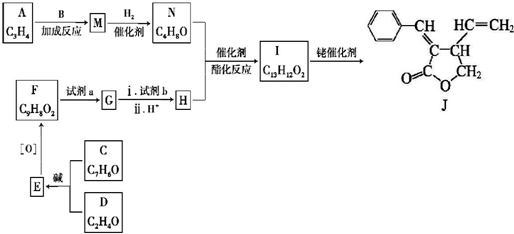
. 分析 苯酚与氢氧化钠反应生成苯酚钠,故A为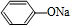 ,由转化关系可知B为
,由转化关系可知B为 ,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是
,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是 ,B与C发生酯化反应生成M,M为
,B与C发生酯化反应生成M,M为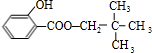 ,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为
,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为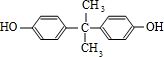 ,据此分析解答.
,据此分析解答.
解答 解:苯酚与氢氧化钠反应生成苯酚钠,故A为 ,由转化关系可知B为
,由转化关系可知B为 ,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是
,C的分子式为C5H12O,C能与金属Na反应,属于饱和一元醇,C的一氯代物有2种,分子中有2种H原子,故C的结构简式是 ,B与C发生酯化反应生成M,M为
,B与C发生酯化反应生成M,M为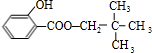 ,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为
,苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为 ,
,
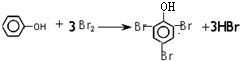
(1)苯酚的俗名是石碳酸,B的官能团名称羧基、酚羟基,
苯酚与浓溴水反应生成三溴苯酚和溴化氢,反应的方程式为: ,
,
故答案为:石碳酸;羧基、酚羟基; ;
;
(2)A为 ,A与CO2在一定条件下反应的化学方程式
,A与CO2在一定条件下反应的化学方程式 ;
;
B为 ,C的结构简式是
,C的结构简式是 ,B与C反应的化学方程式是B与C反应的化学方程式是:
,B与C反应的化学方程式是B与C反应的化学方程式是: +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: ;
;
(3)生成N的反应方程式为: ,该反应属于缩聚反应,
,该反应属于缩聚反应,
故答案为: ;缩聚反应;
;缩聚反应;
(4)以苯酚为基础原料也可以合成防腐剂F.经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31%,则分子中氧原子数目为$\frac{151×31%}{16}$=3,而F完全燃烧只生成CO2和H2O,则只含有C、H、O三种元素,去掉3个氧原子剩余式量为152-48=104,分子中最大碳原子数目为$\frac{104}{12}$=8…8,故F的分子式为C8H8O3,故答案为:C8H8O3;
(5)F的核磁共振氢谱显示其分子中含有4种氢原子,分子结构中不存在“-O-O-”的连接方式,F的结构简式是 ,故答案为:
,故答案为: .
.
点评 本题考查有机合成,试题涉及酚、羧酸等性质与转化,注意根据苯酚、D的分子式、N的结构式推断D的结构,(4)求算有机物同分异构体数目为难点、易错点,侧重考查学生分析推断能力,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:多选题
| A. | Li2NH中N的化合价是-1 | B. | 该反应中H2既是氧化剂又是还原剂 | ||
| C. | H-的离子半径比Li+大 | D. | 此法储氢和钢瓶储氢的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HB-)+2c(H2B)=c(OH-) | B. | c(Na+)+c(OH-)=c(H+)+c(HB-) | ||
| C. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | D. | 2c(B2-)+2c(HB-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应放出大量的热,甲烷可用作气体燃料 | |
| B. | 如温度超过100℃,反应前后气体的体积不变 | |
| C. | 可用干燥的冷烧杯检验生成的产物为CO2和H2O | |
| D. | 此式中使用箭头表示此反应主产物为CO2和H2O,还可能有其他副产物如CO、C等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
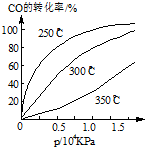 研究NO2、SO2.CO等大气污染气体的处理具有重要意义.
研究NO2、SO2.CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
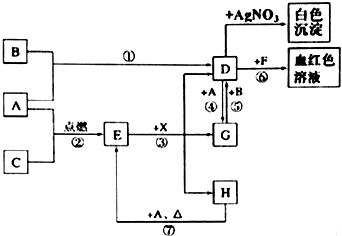
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
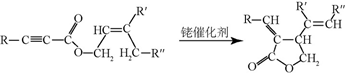
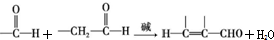
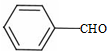 +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$ +H2O.
+H2O.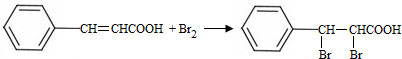 ;试剂b是NaOH、醇溶液.
;试剂b是NaOH、醇溶液.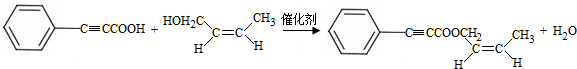 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com