
����Ŀ����֪A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ��ǰ�����ڣ�Aλ�����ڱ���s������ԭ���е��Ӳ�����δ�ɶԵ�������ͬ��B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬A��B����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N�dz������л��ܼ���E�С����������֮�ƣ�E4+���ԭ�ӵĺ�������Ų���ͬ��
��ش��������⣺������ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ��
��1��E�Ļ�̬ԭ�ӵ���Χ�����Ų�ʽΪ ��
��2����A��B��C�γɵ�ABC�����У��������Ҽ������м���
��3������������ȷ���� �� ������ĸ��
a��M������ˮ������ΪM��ˮ���Ӽ����γ��������M�Ǽ��Է��ӣ�N������ˮ������ΪN�ǷǼ��Է���
b��M�Ͷ�����̼�����е�����ԭ�Ӿ�����sp2�ӻ�
c��N�����к���6���Ҽ���1���м�
d��BD2������۵㡢�е㶼�ȶ������辧��ĵ�
��4��E��һ��������Q���侧���ṹ����ͼ��ʾ����Q�Ļ�ѧʽΪ �� �þ�������ԭ�ӵ���λ��Ϊ �� 
��5��B��C��D����Ԫ�صĵ�һ��������С�����˳��Ϊ ��
��6����Ũ��ECl3��������Һ�м������ѣ���ͨ��HCl�����ͣ��ɵõ���λ��Ϊ6�����ΪECl36H2O����ɫ���壬�þ�����������������ʵ���֮��Ϊ1��5����������ӵĻ�ѧʽΪ ��
���𰸡�
��1��3d24s2
��2��2��2
��3��d
��4��TiO2��3
��5��N��O��C
��6��[TiCl��H2O��5]2+
���������⣺A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ��ǰ�����ڣ�Aλ�����ڱ���s������ԭ���е��Ӳ�����δ�ɶԵ�������ͬ����A��HԪ�أ�
B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ����B��CԪ�أ�
Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬M�Ǽ�ȩ����D��OԪ�أ�
CԪ��ԭ������С��D������B��ΪNԪ�أ�
A��B����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N�dz������л��ܼ���Ϊ����
E�С����������֮�ƣ�E4+���ԭ�ӵĺ�������Ų���ͬ��Eԭ�Ӻ��������=18+4=22��ΪTiԪ�أ���1��E��TiԪ�أ���ԭ�Ӻ�����22�����ӣ�����Χ����Ϊ3d��4s���ӣ�3d��4s�ܼ��Ϸֱ���2�����ӣ����̬ԭ����Χ�����Ų�ʽΪ3d24s2 �� ���Դ��ǣ�3d24s2����2����A��B��C�γɵ�HCN�����У���ṹʽΪH��C��N�����۵���Ϊ�Ҽ������������к���һ���Ҽ��������м����÷����к���2���Ҽ���2���м������Դ��ǣ�2��2����3��a��M�Ǽ�ȩ����ȩ������ˮ��N�DZ�������������ˮ����ȩ�ͱ����ǷǼ��Է��ӣ�����ȩ�ܺ�ˮ�γ����������ˮ�����γ���������Լ�ȩ������ˮ������������ˮ���ʴ���
b��M������Cԭ�Ӽ۲���ӶԸ�����3�Ҳ����µ��Ӷԣ�������̼������Cԭ�Ӽ۲���ӶԸ�����2�Ҳ����µ��Ӷԣ����Լ�ȩ��Cԭ�Ӳ���sp2�ӻ���������̼������Cԭ�Ӳ���sp�ӻ����ʴ���
c���������к���12���Ҽ����ʴ���
d�����Ӿ����۷е�С��ԭ�Ӿ��壬������̼�Ƿ��Ӿ��塢����������ԭ�Ӿ��壬�������̼�۷е�С�ڶ������裬����ȷ��
��ѡd����4���þ�����Tiԭ�Ӹ���=1+8�� ![]() =2��Oԭ�Ӹ���=2+4��
=2��Oԭ�Ӹ���=2+4�� ![]() =4�������仯ѧʽΪTiO2��ÿ��Oԭ������3��Tiԭ�ӣ���ԭ����λ����3��
=4�������仯ѧʽΪTiO2��ÿ��Oԭ������3��Tiԭ�ӣ���ԭ����λ����3��
���Դ��ǣ�TiO2��3����5��B��C��D�ֱ���C��N��OԪ�أ�ͬһ����Ԫ��Ԫ�ص�һ����������ԭ��������������������Ƶ���IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ����Ե�һ�����ܴ�С˳����N��O��C��
���Դ��ǣ�N��O��C����6����λ��Ϊ6�����ΪTiCl36H2O����ɫ���壬�þ�����������������ʵ���֮��Ϊ1��5����������ֻ����3��Cl�� �� ����������Ŀ�����H2O��H2O��Cl����ֵΪ5��1�����Ը������ӵĻ�ѧʽΪ[TiCl��H2O��5]2+ ��
���Դ��ǣ�[TiCl��H2O��5]2+ ��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X�ǿ�����ʧ��ҩ��̩��¡��ҽҩ�м��壬��ṹ��ʽ��ͼ��ʾ�������йػ�����X��˵����ȷ���ǣ� ��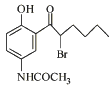
A.�����к���1������̼ԭ��
B.������FeCl3��Һ��Ӧ��������ɫ������
C.���ȵ�KOH��Һ�У��ܷ�����ȥ��Ӧ
D.1 mol������X�������2molBr2����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Mg��Cu��ɵ�2.64g�����Ͷ�뵽100mLϡ��������ȫ�ܽ⣬���ռ���ԭ����NO���壨��ԭ����ֻ��һ�֣���Ȼ����Ӧ�����Һ����μ���2molL��1NaOH��Һ����ͼ�����ɳ��������������NaOH��Һ�����Ĺ�ϵͼ������˵������ȷ���ǣ� �� 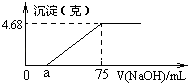
A.ϡ�����Ũ��Ϊ1.9 mol/L
B.���ɵ�NO�ڱ���µ����Ϊ0.896 L
C.a��ֵΪ15 mL
D.Cu�����ʵ���Ϊ0.02 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1�������а������ʣ�Br2��I2��KI��K2SO4��KBrO2��H2SO4��KOH��H2O�������г�һ�����������������Ƿ�Ӧ����������֪Br2��I2��Ϊ�����Ӧ�����ӷ���ʽΪ ��
��2�������ȵİ�ȫ����ǿ����ײʱ��ը�������ķ�Ӧ��� 10NaN3+2KNO3=K2O+5Na2O+16N2�������ж���ȷ����
A.ÿ����8molN2ת��15mol����
B.NaN3�е�Ԫ�ر���ԭ
C.N2�������������ǻ�ԭ��
D.��ԭ������������������֮��Ϊ1��15
��3��ij��ѧ��ȤС��ϣ���ܽϳ�ʱ��۲쵽��ɫ��״ Fe��OH��2�����ɣ���FeSO4����������ϡ���ᷴӦ�Ƶã�����NaOH��Һ��Ӧ��Fe��OH��2��װ��ʾ��ͼ��ͼ��ʾ���ش��������⣺
��i��Aװ�õ���������������Fe��OH��2��װ���У���������Ҫ��Ӧ�����ӷ���ʽ��
��ii��ʵ��ʱ���ȴ���3���رջ���2����Ŀ���� ��
��iii�������Ƶõ�������������������ͨ���������Ӧ�Ļ�ѧ����ʽΪ ��
��iv������C�м������NH4HCO3ʱ����Ӧʱ�����������������Ҫ�����ӷ���ʽ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���Ļ�ѧ���ʸ��������ƣ�Ԥ������ˮ��Ӧ�������������( )
A.HI��HClOB.HCl��HIO
C.HClO3��HIOD.HClO��HClO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±������ڱ��е�һ���֣�����A��I�����ڱ��е�λ�ã��ڣ�1������4��С����Ԫ�ط��Ż�ѧʽ�ش𣬣�5������6��С�ⰴ��ĿҪ��ش�
�� | I A | ��A | ��A | ��A | ��A | ��A | ��A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
��1������Ԫ�أ���ѧ��������õ��� �� ֻ�и��۶������۵��� �� ��������ǿ�ĵ����� �� ��ԭ����ǿ�ĵ����� ��
��2������������ˮ�����м�����ǿ���� �� ������ǿ���� �� �����Ե��� ��
��3��A�ֱ���D��E��F��G��H�γɵĻ������У����ȶ���
��4����B��C��E��F��G��H�У�ԭ�Ӱ뾶������
��5��A��D��ɻ�����ĵ���ʽ
��6��B������������ˮ�����C��������������Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ��ǣ� �� ��Al2O3 ![]() NaAlO2��aq��
NaAlO2��aq�� ![]() Al��OH��3
Al��OH��3
��S ![]() SO3
SO3 ![]() H2SO4
H2SO4
�۱���NaCl��aq�� ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
��Fe2O3 ![]() FeCl3��aq��
FeCl3��aq�� ![]() ��ˮFeCl3
��ˮFeCl3
��MgCl2��aq�� ![]() Mg��OH��2
Mg��OH��2 ![]() MgO��
MgO��
A.�٢ۢ�
B.�ڢۢ�
C.�ڢܢ�
D.�٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ʹ�ò��漰��ѧ�仯����(����)
A. ��������ˮ��B. Һ���������
C. �ܶ����γ�D. ��ʯ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ӫ�����ʵ�˵����ȷ���ǣ� ��
A.��֬���⻯���ڻ�ԭ��Ӧ�������ڼӳɷ�Ӧ��������Ϊ������
B.1mol���ǵ�ˮ�������1mol�����Ǻ�1mol����
C.������Һ��ϡ���Ṳ�Ⱥ���ˮ�ⷴӦ����ȴ�������������Һ��ˮԡ���Ⱥ����ֹ���������
D.��������Һ�еμӱ��͵��������Һ�����ְ�ɫ�������ù��̽��������ʵı���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com