
【题目】冬季是雾霾大气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(l)工业上利用甲烷催化还原NOx可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________。
(2)将CO2转化为甲醇可以实现废物利用,达到节能减排的目的,反应原理可表示为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。请回答:
0~3min内氢气的平均反应速率为______mol/(L·min);
第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和3molH2 (g),则达到平衡时CH3OH的体积分数_________(填“增大”、“减小”或“不变”)。

②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3___0(填“>”、“<”或“=”)。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。
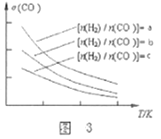
①a、b、c按从大到小的顺序排序为___________。
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______。
A.逆反应速率先增大后减小B.混合气体的密度增大
C.化学平衡常数K值减小D.氢气的转化率减小
【答案】 CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H20(g) △H=-867kJ/mol 0.5 增大 < a>b>c ![]() AC
AC
【解析】(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJmol-1,②CH4(g)+4NO(g) ═2N2(g)+ CO2(g)+2H2O(g)△H=-1160kJmol-1,由盖斯定律(①+②)×![]() 得到CH4(g)+2NO2(g)═N2(g) +CO2(g) +2H2O(g)△H=-867kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol;
得到CH4(g)+2NO2(g)═N2(g) +CO2(g) +2H2O(g)△H=-867kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol;
(2)由图可知,0~3min内二氧化碳的浓度变化为1mol/L-0.5mol/L=0.5mol/L,v(CO2)= ![]() =
=![]() ,则v(H2)=3v(CO2)=0.5mol/(Lmin);开始CO2的浓度为1mol/L,故容器的体积为
,则v(H2)=3v(CO2)=0.5mol/(Lmin);开始CO2的浓度为1mol/L,故容器的体积为![]() =1L,H2的起始浓度为
=1L,H2的起始浓度为![]() =3mol/L,则:
=3mol/L,则:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
开始(mol/L): 1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.750.75 0.75
故该温度下平衡常数k=![]() =5.33;保持温度不变,向该密闭容器中再充入1molCO2(g)和1molH2O(g),则Qc=
=5.33;保持温度不变,向该密闭容器中再充入1molCO2(g)和1molH2O(g),则Qc=![]() <5.33,则平衡正向移动,平衡时CH3OH的体积分数增大,故答案为:0.5;增大;
<5.33,则平衡正向移动,平衡时CH3OH的体积分数增大,故答案为:0.5;增大;
(2)由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,说明升高温度平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
(3)①反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),增大H2的浓度,平衡右移,CO的转化率增大,即投料比
CH3OCH3(g)+H2O(g),增大H2的浓度,平衡右移,CO的转化率增大,即投料比![]() 越高,CO的转化率增大,故答案为:a>b>c;
越高,CO的转化率增大,故答案为:a>b>c;
②对于2CO(g)+4H2(g)CH3OCH3(g)+H2O(g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=![]() ,故答案为:
,故答案为: ![]() ;
;
③A.逆反应速率先增大后减小,说明反应逆向进行,故A正确;B.混合气体的密度增大,说明容器的体积减小,则压强增大,平衡正向移动,故B错误;C.化学平衡常数K值减小,说明平衡逆向进行,故C正确;D.氢气的转化率减小,不一定是平衡逆向进行,还可能是又充入了氢气,故D错误;故答案为:AC。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10 L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。

根据图中数据填空:
(1)该反应的化学方程式为_________________________________。
(2)反应开始至2 min,以气体Z表示的平均反应速率为____________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡状态的是__________(填序号,下同)。
2SO3(g)达到平衡状态的是__________(填序号,下同)。
(2)一定能证明I2(g) +H2(g) ![]() 2HI(g)达到平衡状态的是___________。
2HI(g)达到平衡状态的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 下列结论正确的是
下列结论正确的是
A. 该有机物分子式为C13H16,属于苯的同系物
B. 该有机物密度比水小,与溴水混合后溶液分层,上层为橙红色
C. 该有机物分子至少有4个碳原子共直线,最多有13个碳原子共平面
D. 一定条件下,该有机物可发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,不属于有机物的是( )
A. 丙烷(CH3CH2CH3)B. 醋酸(CH3COOH)
C. 氰化钠(NaCN)D. 乙炔(C2H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,下列操作会使所配得的溶液物质的量浓度偏高的是 ( )
A. 省去洗涤烧杯的步骤
B. 定容时俯视刻度
C. 定容时仰视刻度
D. 定容、摇匀、静置后发现凹液面低于刻度线又加水至刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com