
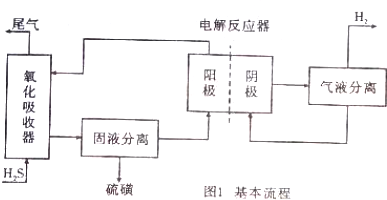
分析 (1)硫化氢与氯化铁发生氧化还原反应,生成单质硫;
(2)电解反应器中,阳极是固液分离液中的亚铁离子发生氧化反应;
(3)通人N2,排除溶液中的氧气,氧气存在氧气要氧化硫化氢,防止干扰三价铁与硫化氢发生氧化反应;
对影响吸收效率的因素可能是气体通入速度太快,铁离子的浓度小和溶液的酸碱性以及反应体系的温度等因素综合考虑;
实验步骤为:分别取等体积、等浓度的FeCl3溶液于不同的试管中,然后向溶液中分别通入氮气赶走其中的氧气,分别向上得溶液中按不同的速度通入硫化氢气体观察现象,并分别用PH计测定溶液的PH的变化;最后得出结论.
(4)因为原溶液是氯化铁,则溶液中一定没有银离子,而加入氯化钡生成白色沉淀,说明与钡离子有关,而原溶液呈酸性,所以排除亚硫酸钡和碳酸钡的可能,由此分析解答.
解答 解:(1)硫化氢与氯化铁发生氧化还原反应,生成单质硫,离子反应为H2S+2Fe3+=2H++S↓+2Fe2+,故答案为:H2S+2Fe3+=2H++S↓+2Fe2+;
(2)电解反应器中,阳极是固液分离液中的亚铁离子发生氧化反应,电极反应式为:Fe2+-e-=Fe3+,故答案为:Fe2+-e-=Fe3+;
(3)溶液中如果存在氧气,氧气优先氧化硫化氢,所以通入氮气的目的是:排除溶液中的O2,防止对实验产生影响,故答案为:排除溶液中的O2,防止对实验产生影响;对影响吸收效率的因素可能是气体通入速度太快,铁离子的浓度小和溶液的酸碱性以及反应体系的温度等因素,假设一:H2S气体的通入速率;
假设二:FeCl3溶液的浓度;假设三:溶液的pH,
实验步骤为:分别取等体积、等浓度的FeCl3溶液于不同的试管中,然后向溶液中分别通入氮气赶走其中的氧气,分别向上得溶液中按不同的速度通入硫化氢气体观察现象,并分别用PH计测定溶液的PH的变化;结论如果两试管中溶液的PH值变化速率与气体通入速率之比相同,说明硫化氢气体的通入速率对吸收速度无影响,
故答案为:FeCl3溶液的浓度;溶液的pH;②向溶液中分别通入氮气;③分别向上述溶液中按不同的速度通入硫化氢气体;④分别用PH计测定溶液的PH的变化;
若两溶液的PH值变化速率与气体通入速率比不同,说明硫化氢气体的通入速率对吸收速度有影响,否则无影响;
(4)因为原溶液是氯化铁,则溶液中一定没有银离子,而加入氯化钡生成白色沉淀,说明与钡离子有关,而原溶液呈酸性,所以排除亚硫酸钡和碳酸钡的可能,所以沉淀是硫酸钡,故答案为:硫酸钡;原溶液中的氯离子排除氯化银生成的可能,而亚硫酸钡在酸性溶液中难生成,则白色沉淀可能为硫酸钡.
点评 本题以脱硫制氢为载体考查了可逆反应、氧化还原反应、电解原理等知识点,本题是一道综合题,难度中等,考查了学生运用知识解决问题的能力,涉及到的知识点较多.


科目:高中化学 来源: 题型:选择题

| A. | 外接负载时,左槽作为原电池负极,发生氧化反应 | |
| B. | 外接电源时,左槽连接外接电源的正极,发生还原反应 | |
| C. | 负载是镀铜的电镀槽时,H+由左槽向右槽移动 | |
| D. | 充电时若转移电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
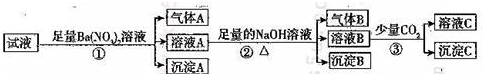
| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2的电子式为 | |
| B. | 16g甲烷完全燃烧生成的CO2为11.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为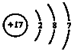 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
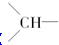 ),并且乙烯基和次甲基之间必须通过甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为C
),并且乙烯基和次甲基之间必须通过甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为C查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | <98.32kJ | B. | >98.32kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑥ | B. | 只有①⑥ | C. | 只有⑥ | D. | 只有①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯中碳碳双键的个数为3 NA | |
| B. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| C. | 0.1mol/L的FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 在标准状况下,2.24 L NO和1.12 L O2混合后的原子总数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com