
 反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:分析 (1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,根据浓度变化量之比等于化学计量数之比计算;
(2)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
(3)第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低;
(4)第三阶段平衡时,A的平衡物质的量为0.50mol/L,B的平衡物质的量为1.50mol,C的物质的量为1.00mol/L,根据平衡常数的计算公式建立平衡常数计算式;
解答 解:Ⅰ.(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2,
故答案为:1:3:2;
(2)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,
故答案为:平衡正向移动;从反应体系中移出产物C;
(3)第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,
故答案为:>;此反应为放热反应,降低温度,平衡向正反应方向移动;
(4)可逆反应A+3B?2C第三阶段达到平衡时A的平衡浓度为0.25mol/L,B的平衡浓度为0.75mol/L,C的平衡浓度为0.50mol/L,此时K=$\frac{(0.5mol/L)^{2}}{0.25mol/L×(0.75mol/L)^{3}}$,故答案为:$\frac{(0.5mol/L)^{2}}{0.25mol/L×(0.75mol/L)^{3}}$;
点评 本题考查化学反应速率与化学平衡图象、化学平衡有关计算、化学反应速率、化学平衡影响因素及化学反应与能量变化等,注意合理分析题中信息数据,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
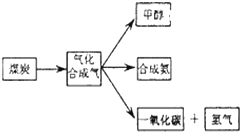
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度小 | B. | 强度高 | C. | 不易生锈 | D. | 导电性好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
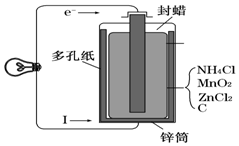 某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.
某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
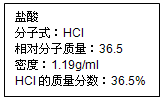 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
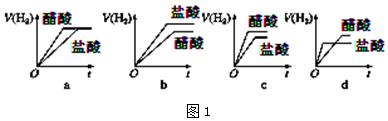
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com