
分析 (1)钠与水反应生成氢氧化钠和氢气,溶质为氢氧化钠,溶液的质量等于钠的质量加水的质量减去氢气的质量;
(2)钠与水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O═2NaOH+H2↑,根据方程式计算.
解答 解:(1)设钠的质量为xg,
2Na+2H2O═2NaOH+H2↑
46 80 2
xg $\frac{80x}{46}$g $\frac{2x}{46}$g
则NaOH的质量分数为=$\frac{\frac{80x}{46}}{x+95.6-\frac{2x}{46}}$×100%=8%,解得x=4.6g,则n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol;
答:投入的Na的物质的量为0.2mol;
(2)钠与水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O═2NaOH+H2↑,
则0.2molNa生成氢气为0.1mol,其体积为0.1mol×22.4L/mol=2.24L
答:标准状况下产生的气体为2.24L.
点评 本题考查了有关方程式的计算、溶液中溶质的质量分数计算,明确发生的化学反应、准确判断溶质和溶液的质量是解题关键,题目难度不大.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳用于灭火 | B. | 氧气供给呼吸 | ||
| C. | 金刚石用作钻探机的钻头 | D. | 用镁制作照明弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
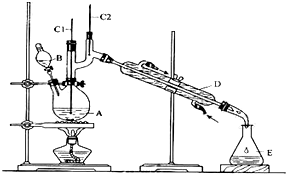
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
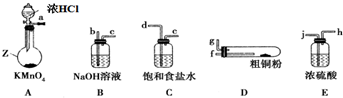

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com