
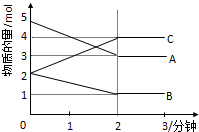
 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:| △n |
| n(总) |
 2C,故答案为:2A+B
2C,故答案为:2A+B 2C;
2C;| △n |
| n(总) |
| 5mol-3mol |
| 5mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、两种元素组成的分子中一定只有极性键 |
| B、分子中的价电子对(包括成键电子对和孤电子对)之间存在相互排斥作用 |
| C、非金属元素组成的化合物一定是共价化合物 |
| D、含有阳离子的物质一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取一小块金属钠,放在燃烧匙里加热,金属钠先熔化,燃烧时火焰为黄色,生成淡黄色固体物质 |
| B、除去NaHCO3溶液中的Na2CO3,应通入过量的CO2气体 |
| C、金属钠与CuSO4溶液反应时,既有沉淀析出,又有气体逸出 |
| D、铯与冷水反应十分剧烈并生成H2,铯的氧化物可直接与水反应生成Cs(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-+CO32-+2H+→HCO3-+H2O |
| B、2OH-+CO32-+3H+→HCO3-+2H2O |
| C、2OH-+CO32-+4H+→CO2↑+3H2O |
| D、OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、IF5+3H2O═HIO3+5HF |
| B、3IBr+2Fe═FeI3+FeBr3 |
| C、BrCl的氧化性强于I2 |
| D、IBr可以与NaOH溶液反应生成2种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
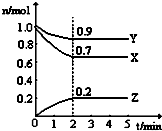 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
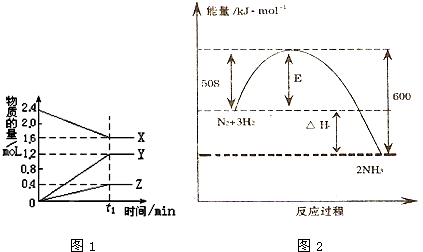
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com