
| A、MgCl2 |
| B、Br2 |
| C、KOH |
| D、H2S |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时电池内部Li+向负极移动 |
| B、电池的负材料为Li |
| C、放电过程中,电池正极材料发生氧化反应 |
| D、充电时阴极反应为:FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、负极Sn-2e→Sn2+ |
| B、正极Fe-2e→Fe2+ |
| C、正极2H2O+O2-2e→4OH- |
| D、负极Fe-2e→Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
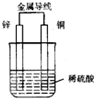 如图是铜锌原电池,某同学做完实验后记录如下:
如图是铜锌原电池,某同学做完实验后记录如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
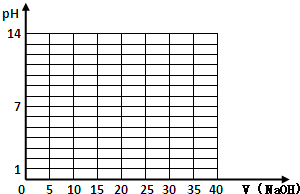
查看答案和解析>>
科目:高中化学 来源: 题型:

| NaCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com