
| A. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)>K(HY) | D. | HX、HY、HZ的酸性依次增强 |
分析 常温下,0.1mol/L的三种盐溶液NaX.NaY.NaZ的PH分别为7、8、9,对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HY>XZ,由此分析解答.
解答 解:A、NaX电离后不水解,X-的物质的量浓度c(X-)=0.1mol/L,NaY、NaZ电离后都部分水解,根据物料守恒可知:c(Y-)+c(HY)=0.1mol/L;c(Z-)+c(HZ)=0.1mol/L,所以c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ),故A正确;
B、酸越弱水解的程度越大,离子浓度越小,所以c(X-)>c(Y-)>c(Z-),故B错误;
C、对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HX>HY>XZ,电离常数K(HY)>K(HZ),故C错误;
D、对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HX>HY>XZ,故D错误;
故选A.
点评 本题考查盐类的水解,题目难度中等,注意酸根离子水解程度越大,对应的酸越弱.


科目:高中化学 来源: 题型:解答题
| 反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/kJ•mol-1 | |
| 硫酸 | 碱溶液 | |||
| ①0.5 mol•L-1 H2SO4溶液50 mL、1.0 mol•L-1 NaOH溶液50 mL | 25.1 | 25.1 | △H1 | |
| ②0.5 mol•L-1 H2SO4溶液50 mL、1.1mol•L-1 NH3•H2O溶液50 mL | 25.1 | 25.1 | △H2 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 酸性氧化物都只能与碱反应不能与任何酸发生反应 | |
| C. | 工业上用焦炭和石英制取粗硅的反应方程式为SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| D. | 不能用SiO2与水反应的方法来制取硅酸,不能用瓷坩埚来加热烧碱或纯碱使其熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期律的实质是元素原子的核外电子排布呈周期性变化 | |
| B. | 利用元素周期律可以预测元素及其化合物的性质 | |
| C. | 元素周期表有7个横行,也就是7个周期 | |
| D. | 元素周期表有18个纵列,也就是18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
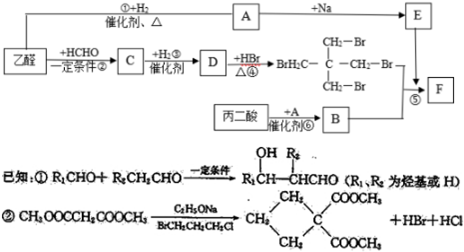
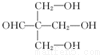 .
. .
.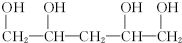 .
.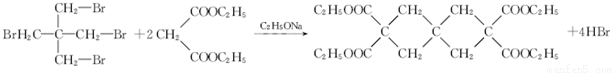 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com