
 2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是| A.Q2 =" 2" Q1 | B.Q1 < 0.5 Q2 | C.Q1 < Q2 < 184.8 kJ | D.Q1 = Q2 < 92.4 kJ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②⑤⑥ | B.②③④⑦. | C.①③⑤⑦ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
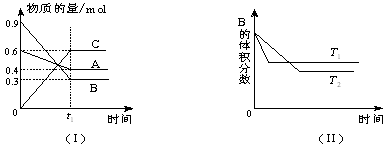
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0. 2 m
2 m ol·L-1·s-1,同时生成1 mol D。试求:
ol·L-1·s-1,同时生成1 mol D。试求:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 z C
z C 2Z(g)+W(g);ΔH<0。达到平衡时,V(A)=" 1.2a" L。
2Z(g)+W(g);ΔH<0。达到平衡时,V(A)=" 1.2a" L。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
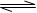 2NH3(g),若在恒温、恒压条件下向平衡体系中通入1mol N2和3mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入lmol N2和3mol H2,平衡后NH3的体积分数为b,则a b(填“大于”、“等于”、“小于”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入1mol N2和3mol H2,平衡后NH3的体积分数为a;若在恒温、恒容条件下向平衡体系中通入lmol N2和3mol H2,平衡后NH3的体积分数为b,则a b(填“大于”、“等于”、“小于”)。
| A.无观显现象 | B.溶液变为红色 | C.溶液红色变浅 | D.有红褐色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,已经达到平衡的标志是
2SO3,已经达到平衡的标志是| A.容器中SO2、O2、SO3共存 |
| B.容器中SO2和SO3的浓度相同 |
| C.容器中SO2、O2、SO3的物质的量为2︰1︰2 |
| D.容器中压强不随时间的变化而改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
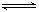 p C在某温度下达到平衡。
p C在某温度下达到平衡。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com