
| A. | 金属钠和石蕊试剂 | B. | Na2CO3溶液和石蕊试剂 | ||
| C. | 酸性KMnO4和溴水 | D. | NaOH溶液和CuSO4溶液 |
分析 六种有机物都易溶于水,其中乙醛含有-CHO,具有还原性,可用新制Cu(OH)2悬浊液检验,乙酸具有酸性,甲酸既具有酸性又具有还原性,以此选择鉴别试剂.
解答 解:A.甲酸、乙酸都具有酸性,加入石蕊不能鉴别,乙醇、丙三醇、乙酸、甲酸都可与钠反应生成氢气,不能鉴别,故A错误;
B.甲酸、乙酸都具有酸性,都与Na2CO3溶液和石蕊试剂反应,和其它物质都不反应,不能鉴别,故B错误;
C.除乙酸外,其它有机物都可被酸性高锰酸钾氧化,不能鉴别,故C错误;
D.氢氧化钠与硫酸铜生成氢氧化铜,丙三醇、葡萄糖与氢氧化铜生成绛蓝色溶液,加热条件下,乙醛、葡萄糖可生成砖红色沉淀,乙酸、甲酸溶解氢氧化铜,加热条件下甲酸与氢氧化铜发生氧化还原反应,可鉴别,故D正确.
故选D.
点评 本题考查有机物的鉴别,为高频考点,把握有机物性质的差异及反应中的不同现象为解答的关键,注意利用不同现象鉴别物质,注意甲酸中含-CHO、-COOH,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 3p3表示3p能级有三个轨道 | |
| B. | 基态碳原子的价电子排布图: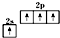 | |
| C. | 冰和固体碘晶体中相互作用力不完全相同 | |
| D. | 某气态团簇分子结构如图所示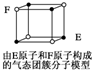 ,该气态团簇分子的分子式为EF或FE ,该气态团簇分子的分子式为EF或FE |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
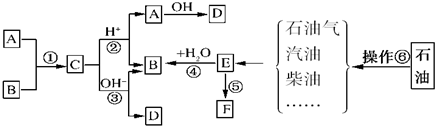
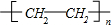 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
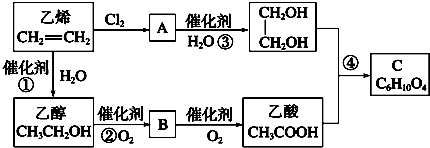
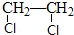 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
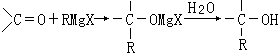
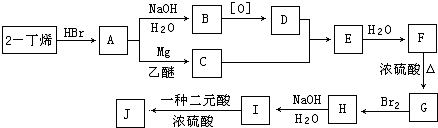
 ,
, ;
; ,I→J
,I→J .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
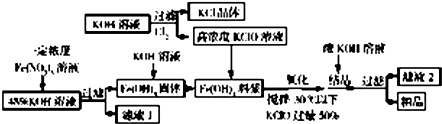
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
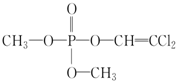
| A. | 洗去沾在手上的敌敌畏用碱性肥皂较好 | |
| B. | 洗去沾在手上的敌敌畏用中性香皂较好 | |
| C. | 敌敌畏极易溶于水 | |
| D. | 敌敌畏可以发生加成反应,不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
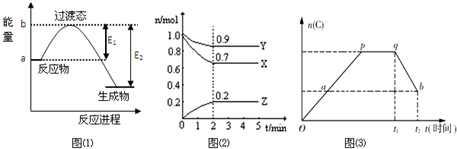
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com