
| A.硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体) |
| B.蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液) |
| C.钠的焰色反应(铂丝、氯化钠溶液、稀盐酸) |
| D.肥皂的制取(蒸发皿、玻璃棒、甘油) |
科目:高中化学 来源:不详 题型:单选题

| A.用排饱和食盐水法收集氯气,瓶内装饱和食盐水,氯气从①口进,②口出 |
| B.该装置中橡皮管的作用是能使水顺利流下 |
| C.除去苯中的己烷 |
| D.制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.瓶中盛有适量浓H2SO4,从A口进气来干燥NH3 |
| B.从B口进气,用排空气法收集CO2 |
| C.瓶中盛满水,从B口进气,用排水法收集NO2 |
| D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液 |
| B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
| C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干 |
| D.为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
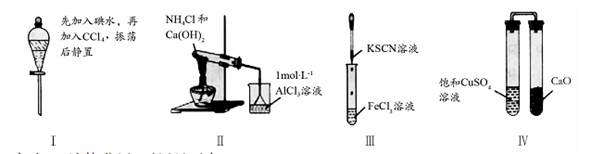
| A.实验Ⅰ:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C.实验Ⅲ:试管中溶液颜色先变为灰绿色后迅速变为红色 |
| D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
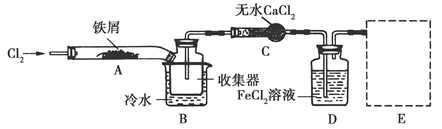
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com