
以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:

分析上述反应,下列判断正确的是____。
循环过程中产生1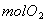 的同时产生
的同时产生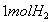
反应①中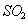 还原性比
还原性比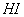 强
强
循环过程中需补充
反应③易在常温下进行
在一定温度下,向2L密闭容器中加入 ,发生反应②.物质的量随时间的变
,发生反应②.物质的量随时间的变 化如图所示。
化如图所示。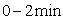 内的平均反应速率
内的平均反应速率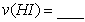
 的转化率=_______
的转化率=_______
恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。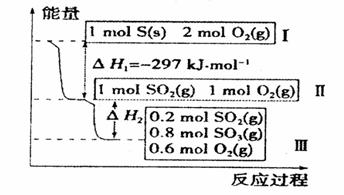 请回答下列问题:
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时,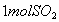 和
和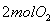 充分反应,放出热量的数值比
充分反应,放出热量的数值比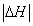 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅(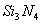 )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:

该反应平衡常数的表达式为K=_______.升高温度,其平衡常数
_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示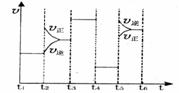
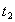 时引
时引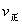 起突变的原因是_____,
起突变的原因是_____,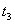 引起变化的因素是_____,
引起变化的因素是_____,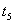 时引
时引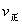 小变化、
小变化、 大变化的原因是_________.
大变化的原因是_________.
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是( )
①用浓硫酸代替稀硫酸
②加热
③改用铝粉
④增大稀硫酸的体积
⑤加水
⑥加入少量硫酸铜
A.全部 B.②③⑥ C.①②③⑥ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
解析下列事实的离子方程式不正确的是
A. 氨水使湿润的红色石蕊试纸变蓝:
B. 工业上用过量的溶液吸收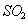 :
: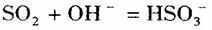
C. 用烧碱溶液清洗铝表面的氧化膜: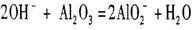
D. 用石灰乳吸收泄漏的氯气: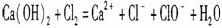
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: 时,
时, 的
的 。下列判断正确的是
。下列判断正确的是
A.  时,饱和
时,饱和 溶液与饱和
溶液与饱和 溶液相比,前者的
溶液相比,前者的 大
大
B.  时,在
时,在 的悬浊液中加入少量的
的悬浊液中加入少量的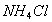 固体,
固体,  增大
增大
C.  时,
时, 固体在20mL0.01
固体在20mL0.01 氨水中的
氨水中的 比在20mL0,01
比在20mL0,01
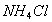 溶液中的
溶液中的 小,
小,
D.  时,在
时,在 的悬浊液中加入
的悬浊液中加入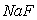 溶液后
溶液后 不可能转化为
不可能转化为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:
N2H4(l)+O2(g)====N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ的热量:
2C(石墨,s)+O2(g)====2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+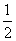 O2(g)====H2O(l) ΔH=-286 kJ·mol-1,
O2(g)====H2O(l) ΔH=-286 kJ·mol-1,
则:2H2O(l)====2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
若把长式元素周期表原先的副族、主族及族号取消,由左至右改为18列,如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是 ( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子最外层有2个电子
C.第16列元素均为非金属元素
D.在整个18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
依据叙述,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、
391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com