
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为__。
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。

装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:__。
(3)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的__(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为________________。
【答案】1 4∶3 2NO+3H2O+4Ce4+===NO3-+NO2-+6H++4Ce3+ 阳极 2H++2HSO3-+2e-===S2O42-+2H2O
【解析】
(1)①化合价升高值=化合价降低值=转移电子数,根据N元素的化合价的变化来确定电子转移数目;
②反应方程式中,系数之比等于物质的量之比,结合元素的化合价变化及原子守恒分析;
(2)生成等物质的量的NO3-和NO2-时,Ce4+被还原为Ce3+,结合电子守恒、电荷守恒分析离子反应;
(3)生成Ce4+为氧化反应,发生在阳极上;反应物是HSO3-被还原成S2O42-,得到电子。
(1)①由反应方程式NO+O3===NO2+O2可知,N元素的化合价从+2价升高到+4价,生成1mol氧气转移电子2mol,则生成11.2L即0.5molO2(标准状况)时,转移电子的物质的量是0.5mol×2=1mol,
故答案为:1;
②当n(NO2)∶n[CO(NH2)2]=3∶2时,即NO2和CO(NH2)2的化学计量数之比是3:2,反应方程式可表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,该反应中只有N元素的化合价变化,氮气既是氧化产物也是还原产物,由N原子守恒可知氧化产物与还原产物的质量比为8:6=4:3,
故答案为:4:3;
(2)由流程图可知,装置II中生成等物质的量的NO3-和NO2-时,Ce4+被还原为Ce3+,根据得失电子守恒和原子守恒,该反应的离子方程式为:2NO+3H2O+4Ce4+===NO3-+NO2-+6H++4Ce3+,
故答案为:2NO+3H2O+4Ce4+===NO3-+NO2-+6H++4Ce3+;
(3)由Ce3+生成Ce4+为氧化反应,所以再生时生成的Ce4+在电解槽的阳极,在电解槽的阴极HSO3-被还原成S2O42-,电极反应式为:2H++2HSO3-+2e-===S2O42-+2H2O,
故答案为:阳极;2H++2HSO3-+2e-===S2O42-+2H2O。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
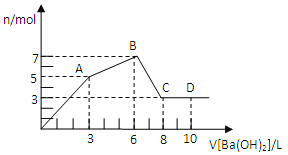
A. 原混合液中c(SO42-):c(Cl-)=1:1
B. 向D点溶液中通入C02气体,立即产生白色沉淀
C. 图中A点沉淀中含有BaSO4和Al(OH)3
D. AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各组溶解度曲线图,判断分离提纯方法。
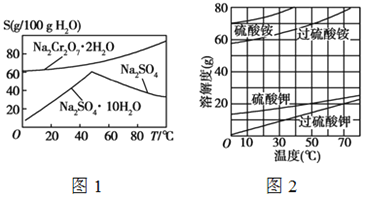
(1)根据图1中Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100 g水),由Na2SO4溶液得到Na2SO4固体的操作为:将溶液升温结晶、 、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是 。
(2)根据图2所示相关物质的溶解度曲线。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中, ,干燥。
(3)根据图1中红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。从Na2Cr2O7和 Na2SO4的混合溶液中提取红矾钠的操作为:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经氯气消毒的自来水,若用于配制以下溶液:①KOH②AgNO3③NaHCO3④FeCl2⑤NaHSO3⑥NaHS,会使配制的溶液变质的是
A.全部B.②④⑤⑥C.②⑤D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含结晶水的无色晶体可表示为B·nH20,其中结晶水的质量分数为28.57%,该晶体的无水物B中碳、氢、氧的质量分数分别为26.67%、2.23%、71.1%。试回答下列问题:
(1)求无水物B的最简式_______。
(2)B和NaOH溶液发生中和反应可生成一种酸式盐和正盐,0.15g无水物B恰好和0.1 mol/LNaOH溶液33.4 mL完全反应生成正盐,求该化合物的分子式,并写出其结构简式_______。
(3)求B·nH2O中的n值_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
H是一种新型香料的主要成分之一,其合成路线如下所示(部分产物和部分反应条件略去):

已知:①RCH=CH2+CH2===CHR′![]() CH2===CH2+RCH===CHR′;
CH2===CH2+RCH===CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2CCH2的同分异构体中存在顺反异构的有机物的名称为____。
(2)A的核磁共振氢谱除苯环上的H外,还显示____组峰,峰面积比为___。
(3)D分子含有的含氧官能团的名称是___,E的结构简式为____。
(4)CH2===CH2发生加聚反应的化学方程式为____;D和G反应生成H的化学方程式为____。
(5)G的同分异构体中,同时满足下列条件的有____种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“—COO—”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于制造飞机的材料应具备高比强度(断裂强度/密度),还应具备密度小、质地轻的特点。以波音747为例,机身每减轻1 kg,因耗油减少,一年可获利2 000美元。你认为下列材料中可用于飞机制造业的是 ( )
A.MgAl合金B.黄铜(CuZn合金)
C.NaK合金D.生铁(FeC合金)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验,。请回答:

(1)固体A的化学式______________。
(2)单质B在氯气中反应的现象_______________________________。
(3)写出C→D在溶液中发生氧化还原反应的离子方程式_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com