
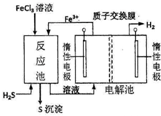
 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
分析 FeCl3溶液氧化H2S发生反应:2FeCl3+H2S=2FeCl2+2HCl+S↓,反应池中溶液移入电解池左槽,而电解池左槽产生Fe3+,右槽生成氢气,因此左槽为阳极、右槽为阴极,由于还原性Fe2+>Cl-,左槽中Fe2+放电生成Fe3+,右槽中氢离子放电生成氢气,质子通过质子交换膜移向阴极.
解答 解:通过图示可知Fe2+在电解池的左槽中转化为Fe3+,H+在右槽转化为H2,因此左槽为阳极右槽为阴极.A.左槽为阳极,由于还原性Fe2+>Cl-,因此电极反应式为:Fe2+-e-=Fe3+,故A错误;
B.右槽为阴极,因此电极反应式为:2H++2e-=H2↑或2H2O=H2↑+2OH-,故B正确;
C.电解过程中阳离子向阴极移动,故C正确;
D.在反应池中FeCl3和H2S反应为:2Fe3++H2S=2 Fe2++S+2H+,因此FeCl3溶液可以循环利用,故D正确,
故选:A.
点评 本题考查电解工作原理,电解本质是氧化还原反应,理解电极反应与离子的放电顺序是关键,难度不大.


科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
36.5gHCl气体溶解在1L水中(水的密度近似为1g/cm3), 所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是
A.所得溶液的物质的量浓度为1mol/L
B.所得溶液中含有NA个HCl分子
C.36.5gHCl气体占有的体积为22.4L
D.所得溶液的质量分数:ω=36.5c/(1000ρ)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
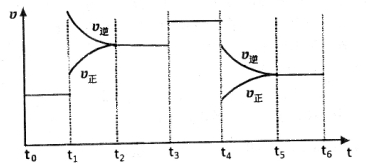
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为4mol/L | |
| B. | 原溶液中c(Cu2+)为1mol/L | |
| C. | 电解后溶液中c(H+)为8mol/L | |
| D. | 电解后加入1molCu(OH)2可使溶液复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①③⑥ | C. | ③⑤⑥⑦ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
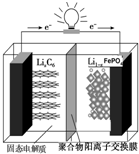 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com