配制100ml 0.1mol?L-1的氢氧化钠溶液:
(1)配制时应选用容量瓶的规格和称取固体氢氧化钠的质量正确的是 .
a.300ml 2.4g b.100ml 0.4g c.200ml 4.0g d.任意规格 4.0g
(2)在该实验中要用到容量瓶,使用容量瓶的第一步操作是 .
(3)针对此实验过程设计了5个操作步骤:
①向盛有烧碱的烧杯中加入20ml的蒸馏水使其溶解;
②继续往容量瓶中加蒸馏水至液面接近刻度线1cm-2cm;
③将氢氧化钠溶液沿玻璃棒注入容量瓶中;
④在烧杯中加入少量蒸馏水,小心洗涤2-3次后移入容量瓶中;
⑤改用胶头滴管加蒸馏水至溶液的凹液面与刻度线相切,再将容量瓶塞盖好,反复上下颠倒,摇匀.正确的操作顺序为 .
(4)上述操作⑤中,如果不小心加水超过刻度线,采取的补救措施为 .
(5)以下操作会导致溶液浓度偏低的是 .
a.在烧杯中溶解时,有少量液体溅出
b.定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
c.容量瓶使用前未干燥
d.所使用的容量瓶事先用某种浓度的氢氧化钠溶液润洗过
e.定容后加盖摇匀,分装入刚用蒸馏水洗净的试剂瓶中.
【答案】
分析:(1)根据m=nM=CVM计算溶质的质量.
(2)容量瓶前使用前检查是否漏水;
(3)根据浓溶液来配制稀溶液的实验操作步骤来解答.
(4)根据是否对配制溶液的浓度有影响判断.
(5)根据C=
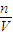
判断,如果溶质的物质的量偏大或溶液的体积偏小,会导致配制溶液的浓度偏低.
解答:解:(1)m=nM=CVM=0.1mol?L
-1×0.1L×40g/mol=0.4g;配制100mL溶液应选取100mL的容量瓶.
故选b.
(2)容量瓶在使用前检查是否漏水,故答案为:检查是否漏水;
(3)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,故答案为①③④②⑤.
(4)如果不小心加水超过刻度线,导致配制的溶液浓度偏小,需重新配制.
故答案为:重新配制.
(5)a.在烧杯中溶解时,有少量液体溅出,溶质的物质的量偏小,导致配制的溶液浓度偏低,故正确.
b.定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线,溶液的体积偏大,导致配制的溶液浓度偏低,故正确.
c.容量瓶使用前未干燥,溶质的物质的量和溶液的体积都不变,所以配制的溶液浓度不变,故错误.
d.所使用的容量瓶事先用某种浓度的氢氧化钠溶液润洗过,溶质的物质的量偏大,所以导致配制的溶液浓度偏大,故错误.
e.定容后加盖摇匀,分装入刚用蒸馏水洗净的试剂瓶中,溶液的体积偏大,导致配制的溶液浓度偏低,故正确.
故选abe.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,会根据C=

判断配制溶液的浓度偏高还是偏低.

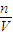 判断,如果溶质的物质的量偏大或溶液的体积偏小,会导致配制溶液的浓度偏低.
判断,如果溶质的物质的量偏大或溶液的体积偏小,会导致配制溶液的浓度偏低. 判断配制溶液的浓度偏高还是偏低.
判断配制溶液的浓度偏高还是偏低. 

 阅读快车系列答案
阅读快车系列答案
