
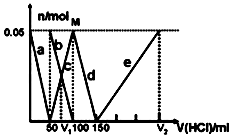
 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | V1:V2=1:4 |
分析 Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸后,首先发生反应:AlO2-+H++H2O═Al(OH)3↓,a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
发生反应Al(OH)3+3H+═Al3++3H2O,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,进而求出消耗盐酸的体积.
解答 解:Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,先发生的反应为:AlO2-+H++H2O═Al(OH)3↓,则a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
AlO2-反应完毕后发生反应:CO32-+H+═HCO3-,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸体积为:100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
CO32-反应完后又发生反应:HCO3-+H+═CO2↑+H2O,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸体积为:150mL-100mL=50mL,根据方程式可知:n(HCO3-)=n(H+)=0.05mol;
最后发生反应为:Al(OH)3+3H+═Al3++3H2O,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知:n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为:$\frac{0.15mol}{1mol/L}$=0.15L=150mL;
A.由上述分析可知,a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓,故A错误;
B.根据述分析可知,M点时溶液中CO32-完全转化为HCO3-,没有CO2生成,故B错误;
C.由上述分析可知,原混合溶液中的CO32-与AlO-2的物质的量之比为:0.05mol:0.05mol=1:1,故C错误;
D.原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应CO32-+H+═HCO3-可知,需要盐酸为0.025mol,盐酸的体积为25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故D正确;
故选D.
点评 本题结合图象曲线考查了有关混合物反应的计算,题目难度较大,明确离子性质及反应的先后顺序为解答关键,试题侧重考查对图象曲线的分析、理解能力及化学计算能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | X只能形成一种氧化物 | |
| B. | 化合物YX比WX3的熔点高 | |
| C. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| D. | 原子半径的大小顺序:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| 古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇能发生取代反应和加成反应 | |
| B. | 1mol 3-(2-噻吩)丙烯酸(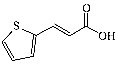 )发生加成反应时最多消耗3mol H2 )发生加成反应时最多消耗3mol H2 | |
| C. | 淀粉和纤维素的分子通式均为(C6H10O5)n,故淀粉和纤维素互为同分异构体 | |
| D. | 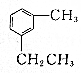 与 与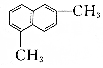 都属于芳香烃,二者互为同系物 都属于芳香烃,二者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${V}_{N{H}_{3}}$=0.6mol/L•min | B. | ${V}_{{N}_{2}}$=0.005mol/L•s | ||
| C. | ${V}_{{H}_{2}}$=0.9mol/L•min | D. | ${V}_{N{H}_{3}}$=0.02mol/L•s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| C. | 4.6gNO2在标准状况下,含有的分子数为0.1NA | |
| D. | 50mL12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 500 | 4 600 | 6 900 | 9 500 |
| S | 740 | 1 500 | 7 700 | 10 500 |
| T | 580 | 1 800 | 2 700 | 11 600 |
| U | 420 | 3 100 | 4 400 | 5 900 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HC1O |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,CuS的溶解度小于ZnS的溶解度 | |
| B. | 除去工业废水中的Fe2+,可以选用CuS做沉淀剂 | |
| C. | 足量CuSO4溶解在0.1mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol/L | |
| D. | 在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com