
| A. | 非极性键不可能存在于离子化合物中 | |
| B. | 制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 | |
| C. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| D. | 单质分子中均不存在化学键 |
分析 A.离子化合物中一定含有离子键,可能含有非极性键;
B.优良的催化剂和耐高温、耐腐蚀的合金材料大多属于过渡元素;
C.酸与碱稀溶液发生中和反应生成1mol水时所释放的热量称为中和热;
D.双原子或多原子分子中存在化学键.
解答 解:A.离子化合物中一定含有离子键,可能含有非极性键,如Na2O2,存在O-O非极性键,属于离子化合物,故A错误;
B.在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料,故B正确;
C.酸与碱稀溶液发生中和反应生成1mol水时所释放的热量称为中和热,故C错误;
D.双原子氯气或多原子白磷分子中存在共价键,故D错误;
故选B.
点评 本题考查化学键、元素周期表与元素周期律应用、中和热、同主族元素化合物性质相似性与递变性等,比较基础,注意理解中和热:应为稀的酸、碱溶液反应,生成的水为1mol.


科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×103 | D. | 104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 可能不形成化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
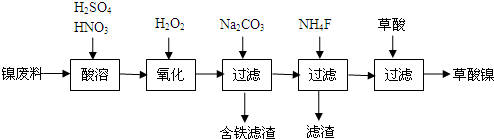
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:Al-3e-+3H2O=Al(OH)3+3H+ | |
| B. | 放电过程中,Cl-向正极移动 | |
| C. | 每转移0.2mol电子,理论上生成0.1molH2S气体 | |
| D. | 处理过程中银器一直保持恒重 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH | |
| B. | 饱和食盐水中先通入的气体为CO2 | |
| C. | 流程图中的系列操作中一定需要玻璃棒 | |
| D. |  如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com