
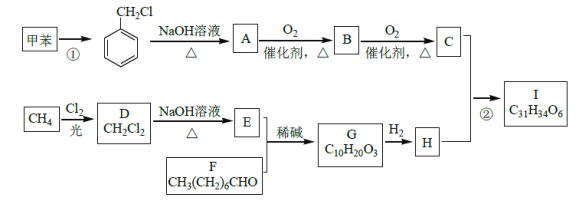
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如图:
已知:a.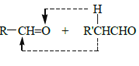
![]()
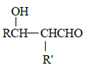
b.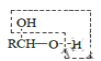
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是___;F的化学名称为___。
(2)②的反应类型是___;A→B的化学方程式为____。
(3)G的结构简式为____;H中所含官能团的名称是___。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W的结构简式___。
①遇FeCl3溶液显紫色②属于芳香族化合物③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备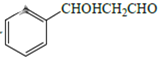 的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
【答案】Cl2、光照 辛醛 取代反应 2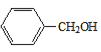 +O2
+O2![]() 2
2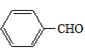 +2H2O
+2H2O 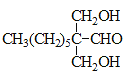 羟基 13
羟基 13 ![]()
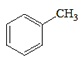
![]()
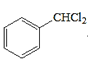
![]()
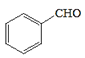
![]()
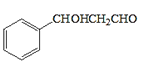
【解析】
甲烷和氯气在光照条件下发生取代反应生成D(CH2Cl2),D在氢氧化钠的水溶液、加热条件下发生取代反应,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则E为HCHO,CH3(CH2)6CHO和甲醛反应生成G,根据题给信息知G为 ,G和氢气发生加成反应生成H为
,G和氢气发生加成反应生成H为 ;甲苯在光照条件下与氯气发生取代反应生成
;甲苯在光照条件下与氯气发生取代反应生成![]() ,
,![]() 水解得到A为
水解得到A为![]() ,A氧化生成B为
,A氧化生成B为![]() ,B进一步氧化生成C为
,B进一步氧化生成C为![]() ,C与H发生酯化反应生成I为
,C与H发生酯化反应生成I为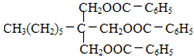 ;
;
(5)苯与氯气在光照条件下生成 ,然后发生水解反应生成
,然后发生水解反应生成![]() ,最后与乙醛在碱性条件下反应生成目标物。
,最后与乙醛在碱性条件下反应生成目标物。
(1)反应①为甲苯和氯气在光照条件下发生取代反应生成![]() ,该反应所需试剂、条件分别是Cl2、光照;用系统命名法命名F的化学名称为辛醛;
,该反应所需试剂、条件分别是Cl2、光照;用系统命名法命名F的化学名称为辛醛;
(2)C与H发生酯化反生成I为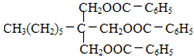 ,则②的反应类型是酯化反应或取代反应;A为
,则②的反应类型是酯化反应或取代反应;A为![]() ,A氧化生成B为
,A氧化生成B为![]() ,A→B的化学方程式为 2
,A→B的化学方程式为 2 +O2
+O2![]() 2
2 +2H2O;
+2H2O;
(3)G 的结构简式为 ;H 为
;H 为 ,所含官能团的名称是:羟基;
,所含官能团的名称是:羟基;
(4)C为![]() ,化合物W的相对分子质量比化合物C大14,W比C多一个CH2,遇FeCl3溶液显紫色,说明含有酚羟基,说明含有苯环属于芳香族化合物;能发生银镜反应,说明含有醛基;①苯环上有三个取代基,分别为醛基、羟基和甲基,先固定醛基和羟基的位置,邻间对,最后移动甲基,可得到10种不同结构;②苯环上有两个取代基,分别为-OH和-CH2CHO,邻间对位共3种,所以W的可能结构有10+3=13种;其中核磁共振氢谱显示有5种不同化学环境的氢、峰面积比为2:2:2:1:1,其结构简式:
,化合物W的相对分子质量比化合物C大14,W比C多一个CH2,遇FeCl3溶液显紫色,说明含有酚羟基,说明含有苯环属于芳香族化合物;能发生银镜反应,说明含有醛基;①苯环上有三个取代基,分别为醛基、羟基和甲基,先固定醛基和羟基的位置,邻间对,最后移动甲基,可得到10种不同结构;②苯环上有两个取代基,分别为-OH和-CH2CHO,邻间对位共3种,所以W的可能结构有10+3=13种;其中核磁共振氢谱显示有5种不同化学环境的氢、峰面积比为2:2:2:1:1,其结构简式:![]() ;
;
(5)苯与氯气在光照条件下生成 ,然后发生水解反应生成
,然后发生水解反应生成![]() ,最后与乙醛在碱性条件下反应生成目标物,合成路线流程图为:
,最后与乙醛在碱性条件下反应生成目标物,合成路线流程图为: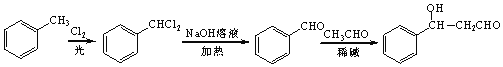 。
。


科目:高中化学 来源: 题型:
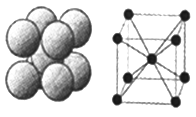
【题目】【化学选修3:物质结构与性质】A、B、C、D、E五种元素的原子序数依次增大,其中非金属元素A的基态原子中成对电子数是未成时电子数的两倍,C元素在地壳中含量最高,D的单质是短周期中熔点最低的金属,E的合金是我国使用最早的合金。
(1)E元素的基态原子电子排布式为__________________。
(2)A的某种氢化物A2H2分子中含有___个σ键和____个π键。
(3)A 的含氧酸根离子AO3n-的空间构型是___________。
(4)B的最简单的氢化物的沸点比A 的最简单的氢化物的沸点高得多,其原因是_____。
(5)E的最高价氧化物对应的水化物溶解于氨水中生成的复杂化合物的化学式是______。
(6)下图是D单质的晶体堆积方式,这种堆积方式的晶胞中原子的配位数为____,若该原子的半径为rpm ,此晶体的密度ρ=______g/cm3(用含r的代数式表示,阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
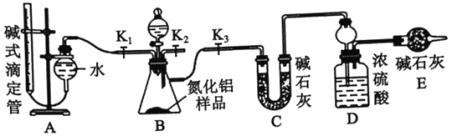
【题目】工业制得的氮化铝(AlN)产品中常含有少量 Al4C3、Al2O3 、C 等杂质。某化学实验小组设计了如下实验, 分别测定氮化铝(AlN)样品中 AlN 和 Al4C3 的质量分数(忽略NH3在强碱溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸发生复分解反应,写出该反应的化学方程式 ___________。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN和NaOH溶液反应的化学方程式_______。实验装置如下图所示:
(2)实验过程:
①根据题干信息:连接实验装置,检查装置气密性。称得D装置的质量为y g,滴定管的读数为amL。该步骤中,检查装置A气密性的操作为___________。
②称取x g AlN 样品置于锥形瓶中; 塞好胶塞, 关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入足量的____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3, 通过分液漏斗加入过量_________(填化学式),与锥形瓶内溶质充分反应。
④_____(填入该步应进行的操作)。
⑤实验中记录滴定管的读数为b mL,称得D装置的质量为z g。
(3)数据
①AlN 的质量分数为____________。
②若读取滴定管中气体的体积时,先冷却到室温,再__________,然后平视凹液面读数。液面左高右低,则所测气体的体积___________(填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 ____________(该实验条件下气体摩尔体积为Vm molL-1) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 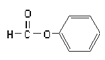 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上曾利用“地康法”制氯气,其原理是以氯化铜作催化剂,利用氧气氧化氯化氢。如图为“地康法”制氯气的模拟装置.下列关有说法不正确的是
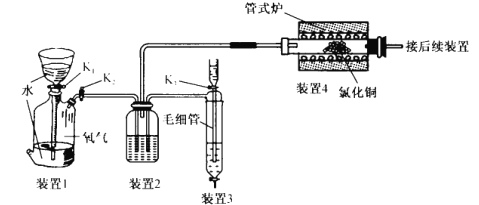
A.关闭 K2打开K1, 若漏斗中的液面不持续下降 ,则装置1的气密性良好
B.打开K3 ,将浓盐酸逐滴滴入浓硫酸中可制备反应所需要的氯化氢
C.装置 2 中盛放的是浓硫酸,通过观察气泡逸出的快慢可判断气体的通入量
D.后续需要净化氯气的装置中 ,除杂试剂依次为饱和食盐水、碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯基铁[ Fe(C5H5)2]是一种有机过渡金属化合物,常温下为橙黄色粉末,难溶于水,易溶于有机溶剂,温度超过100 °C能够升华,实验室制备环戊二烯基铁的装置和步骤如下:
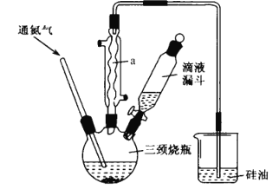
实验步骤:
步骤1:在三颈烧瓶中加入10mL乙二醇二甲醚(作溶剂)和4. 5 g研细的 KOH 粉末,通入氮气并开启磁力搅拌器 ,然后加入1. 5mL环戊二烯(过量);
步骤2:将1.5g FeCl24H2O溶于5 mL二甲基亚砜中 ,并转入滴液漏斗中,将步骤1中的混合物猛烈搅拌10 min,打开滴液漏斗将氯化亚铁的二甲基亚砜溶液在45 min钟左右滴完;
步骤3:关闭滴液漏斗,在氮气保护下继续搅拌30 min;
步骤4:将反应后的混合液倒入100 m L烧杯内,加入少量盐酸除去剩余的KOH,再加入20mL 水,继续搅拌悬浊液15min,抽滤产物,并用水洗涤产物3~4次,最后将产物铺在面皿上,置于真空干燥器内干燥。回答下列问题:
(1)仪器a的作用是___________________。
(2)制备过程中若不通入氮气,会降低环戊二烯基铁的产率,试分析其中的原因: __________。
(3)硅油的主要作用是______。
(4)步骤4中分离环戊二烯基铁也可采用如下方法,请将分离步骤补充完整:向反应后的混合液加入10 mL乙醚(ρ= 0.71g cm-3 ) 充分搅拌,然后转入_____(填仪器名称)中,依次用盐酸、水各洗涤两次,待液体分层后_____________(填完整操作过程),将含有二环戊二烯基合铁的溶液在通风橱中蒸发得到二环戊二烯基合铁粗产品。
(5)可采用如图所示的简易装置分离提纯环戊二烯基铁。将颗粒状环戊二烯基铁放入蒸发皿中并小火加热,环戊二烯基铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______________,装置棉花的作用是___________。
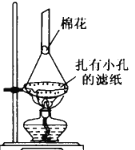
(6)若最终制得环戊二烯基铁质量为 0.16g,则产率为_____%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,它可以发生反应的类型有( )
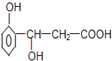
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A. ①②③④B. ①②④⑤
C. ①②⑤⑥D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向NH4HSO4溶液中滴加NaOH溶液至水的电离程度最大:2OH-+NH4++H+=NH3·H2O+H2O
B.硫酸型酸雨久置,pH减小:![]()
C.将Cl2通入少量FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
D.4mol·L-1的NaAlO2溶液和7mol·L-1的盐酸等体积混合:![]() +7H++H2O=3Al(OH)3↓+Al3+
+7H++H2O=3Al(OH)3↓+Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com