
按要求填空:
(1)航天技术上使用的氢氧燃料电池具有高能、轻便、不污染环境等优点,碱式氢氧燃料电池中的电解质是碱,其正极反应表示为:O2+2H2O+4e- 4OH-,则其负极反应可表示为__________________。
4OH-,则其负极反应可表示为__________________。
(2)在一定条件下,RO3n-和I-发生反应的离子方程式如下: RO3n-+6I-+6H+=R-+3I2+3H2O
则R元素的原子最外层电子有 个。
(3)Na2SX在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
(4)CH4和H2O(g)通入聚焦太阳能反应器中,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器中,某温度下反应达到平衡时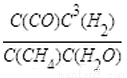 =27,此时测得n(CO)=0.2mol,则平衡时CH4的转化率为 .(计算结果保留三位有效数字)。
=27,此时测得n(CO)=0.2mol,则平衡时CH4的转化率为 .(计算结果保留三位有效数字)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:推断题
R、Q、X、Y、Z是原子序数依次增大的五种短周期元素,R与Q形成的气态化合物,在标准下的密度为0.76 g/L,X、Y、Z三种元素族序数之和为10,Y是地壳中含量最多的金属元素,Y单质能强碱溶液反应,Z元素原子最外层电子数是电子层数的两倍。
(1)X在周期表中的位置 ;X、Y、Z三种元素形成的简单离子半径由大到小的顺序是 。(用离子符号回答)
(2)X和R两种元素按原子个数比1:1组成的化合物的电子式为 ,推测这种化合物具有较强的 。(填“氧化性”或“还原性”)
(3)写出Y、Z两种元素最高价氧化物对应的水化物相反应的离子方程式: 。
(4)水的沸点远高于Z元素的氢化物的沸点,原因是 。
(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,推算其分子中含有 对共用电子。
(6)由R、Q两元素组 成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为 。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为 。
成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为 。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
有机物正确命名为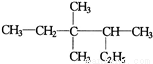 正确命名为( )
正确命名为( )
A.2-乙基-3,3-二甲基-4-乙基戊烷
B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷
D.2,3,3-三甲基己烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
在标准状况下,10mL某气态烃在80mLO2中充分燃烧后,恢复到标准状况,所得气体的体积为60mL,该烃可能是( )
A.C3H8 B.C3H6 C.C3H4 D.C4H10
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B.分子组成符合CnH2n+2的烃一定是烷烃
C.正戊烷分子中所有原子均在一条直线上
D.碳氢原子个数比为1:3的烃有2种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
下列有关实验原理、操作或现象不正确的是( )
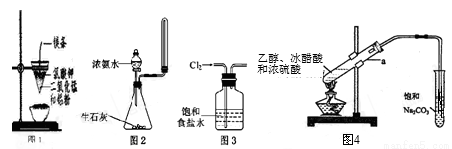
A.图1装置可制得金属锰,用同样的装置可制得金属铬
B.实验室用图2所示装置制取少量氨气
C.实验室用图3所示装置除去Cl2中的少量HCl
D.实验室用图4所示装置制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
某烷烃的一种同分异构体只能生成一种一氯代物,则该烃的分子式不可能的( )
A.C2H6 B.C4H10 C.C5H12 D.C8H18
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:选择题
甲、 乙、丙、X是中学化学中常见的4种物质,其转化关系符合下图。其中甲和X可能是( )
乙、丙、X是中学化学中常见的4种物质,其转化关系符合下图。其中甲和X可能是( )
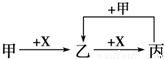
A.甲为Fe、X为Cl2
B.甲为S、X为O2
C.甲为SO2、X为NaOH溶液
D.甲为AlCl3溶液、X为NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:简答题
【化学—选修3: 物质结构与性质】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是______________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。
该合金的晶胞结构如图所示。
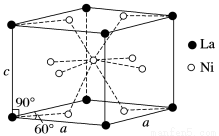
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com