
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
分析 (1)根据反应前后元素化合价变化情况是否合理来分析;
(2)根据能量变化图计算反应热,反应热=吸收的总能量-放出的总能量,再根据热化学方程式的书写规则书写;
(3)①根据平衡转化率的判断,两种或两种以上的反应物,增加其中一种物质的物质的量,提高另外一种物质的转化率,自身的转化率降低;
②考查化学平衡的计算----三段式,化学反应速率的计算;
③考查外界条件改变(温度)对化学平衡的影响;升高温度,平衡向吸热方向移动,降低温度,平衡向放热方向移动.通过图象反应化学平衡移动定律.
④考查电化学中给定条件下的电极反应式的书写;有氧化还原知识判断反应物和生成物,根据化合价变化确定得电子数目,根据反应所处的介质补H+.
(4)B、由表中数据可知,实验①②中金属均过量,所以铁的氧化产物是硝酸亚铁.实验②比实验①多溶解了18.0g-9.6g=8.4g金属,而还原产物NO多了4.48L-2.24L=2.24L,即物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol,根据得失电子数目相等,因此金属的相对原子质量=8.4÷(0.3÷2)=56,这说明溶解的金属恰好是铁,因此实验①中也恰好溶解了8.4g铁.
A、实验①中生成硝酸亚铁0.15mol,NO是0.1mol,实验根据氮原子守恒可知,参加反应的硝酸是0.15mol×2+0.1mol=0.4mol,所以稀硝酸的浓度是0.4mol÷0.1L=4mol/L;
C、实验③比实验②多溶解了9.6g金属,多生成的NO是6.72L-4.48L=2.24L,物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol.如果9.6g金属恰好是铜,则移电子是$\frac{9.6g}{64g/mol}$×2=0.3mol,这说明9.6g金属就是Cu,实验③中n(Cu2+)=$\frac{0.3mol/L}{2}$=0.15mol/L.
D.实验③中,金属全部溶解,但由于溶液中含有Fe2+,所以继续加入硝酸或继续产生NO,④中V>6.72 L.
解答 解:(1)A、生成N2,N元素化合价升高了,生成SO2,S元素化合价降低了,符合氧化还原反应原理,预测合理,A正确;
B、生成NH3、SO3、H2O均没有化合价变化,为非氧化还原反应,预测合理,B正确;
C、生成SO2,S元素化合价降低,生成SO3,没有元素化合价的升高,不符合氧化还原反应原理,预测不合理,C错误;
D、既有元素化合价的升高又有元素化合价的降低,预测合理,A正确.
故选:C.
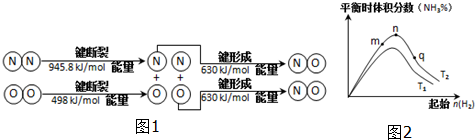
(2)现根据题意写出对应的方程式:N2(g)+O2(g)=2NO(g)
△H=吸收的总能量-放出的总能量=945.8KJ/mol+498KJ/mol-2×630KJ/mol=183.8KJ/mol
故答案为:N2(g)+O2(g)=2NO(g)△H=+183.8 kJ/mol.
(3)①根据平衡转化率的判断,两种或两种以上的反应物,增加其中一种物质的物质的量,提高另外一种物质的转化率,自身的转化率降低,故
H2的物质的量越大,N2的转化率越高,所以P点的转化率最高;
故答案为:P.
②N2(g)+3H2(g)?2NH3(g) 因为反应物的转化率均为a,所以α(H2)=$\frac{y}{3xa}$=a,所以y=3x
起始浓度:$\frac{x}{2}$ $\frac{y}{2}$ 0
变化浓度:$\frac{xa}{2}$ $\frac{3xa}{2}$ xa
平衡浓度:$\frac{x-xa}{2}$ $\frac{y-3xa}{2}$ xa
v=$\frac{△c}{△t}$=$\frac{xa}{6}$mol•L-1•min-1
K=$\frac{(xa)^{2}}{\frac{(x-xa)}{2}\frac{(y-3xa)^{3}}{8}}$=$\frac{16(xa)^{2}}{(x-xa)(-3xa)^{3}}$=$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$
故答案为:$\frac{xa}{6}$mol•L-1•min-1;$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$;
③(垂直于x轴作一条辅助线,选择H2的物质的量相同的,温度不同的两个点)假设T2>T1,升高温度有T1到T2,该反应是放热反应,
温度升高平衡逆向移动,NH3%减小,与图象所示相反,故假设错了,应该是T1>T2;
故答案为:低于.
④由题意可知:写出电化学合成过程中发生还原反应,是化合价升高的反应,从总方程式可知,N2到NH3,2个0价的N到2个-3价的N得到6个电子,
根据题目中告诉传导H+,故根据电荷守恒,式子左边不6H+,得电极反应式为N2+6H++6e-=2NH3.
故答案为:N2+6H++6e-=2NH3.
(4)B、铁的金属性强于铜,所以稀硝酸首先氧化单质铁,然后再氧化单质铜.由表中数据可知,实验①②中金属均过量,所以铁的氧化产物是硝酸亚铁.实验②比实验①多溶解了18.0g-9.6g=8.4g金属,而还原产物NO多了4.48L-2.24L=2.24L,即物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol.所以8.4g金属也转移0.3mol电子,因此金属的相对原子质量=8.4÷(0.3÷2)=56,这说明溶解的金属恰好是铁,因此实验①中也恰好溶解了8.4g铁,B不正确;
A、实验①中生成硝酸亚铁0.15mol,NO是0.1mol,实验根据氮原子守恒可知,参加反应的硝酸是0.15mol×2+0.1mol=0.4mol,所以稀硝酸的浓度是0.4mol÷0.1L=4mol/L;
C、实验③比实验②多溶解了9.6g金属,多生成的NO是6.72L-4.48L=2.24L,物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol.如果9.6g金属恰好是铜,则移电子$\frac{9.6g}{64g/mol}$×2=0.3mol,这说明9.6g金属就是Cu,n(Cu2+)=$\frac{0.3mol/L}{2}$=0.15mol/L,C正确;
D.实验③中,金属去不溶解,但由于溶液中含有Fe2+,所以继续加入硝酸或继续产生NO,④中V>6.72 L所以D不正确.
故答案为:AC.
点评 本题目为综合性题目,考查了热化学方程式的书写,化学平衡的三段式计算,影响化学平衡转化率的因素及给定条件下电极反应式的书写(注意反应的酸碱介质问题).特别是第(4)题,本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是解题关键,侧重对学生综合能力的考查,本题过程复杂、计算量较大,为易错题目,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 2NO2?N2O4-----①N2O4?2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数 | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K101kPa条件下放热量为0.573kJ | |
| C. | 已知298K 时,0.10mol/L HAc的电离度为1.32%.在0.10mol/L HAc 和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化: HAc?H++Ac----①,NaAc=Na++Ac-----②,Ac-+H2O?HAc+OH-----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 | |
| D. | 将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BeCl2分子的电子式: | |
| B. | 质子数为116,中子数为177的鉝(Lv)原子:${\;}_{116}^{293}$Lv | |
| C. | 氯离子的结构示意图: | |
| D. | 苯甲醇的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 互为同分异构体 | B. | 均能与Na反应且产物相同 | ||
| C. | 均可发生取代反应和加成反应 | D. | 分子中共平面的碳原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
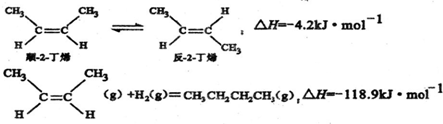
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: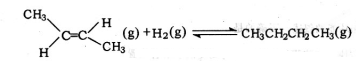 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | H->Li+ | KCl<Si | HClO3<HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] | |
| C. | 一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| D. | 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com