
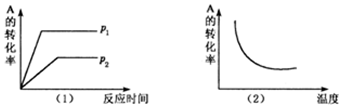
分析 根据图(1)到达平衡时所用时间的长短判断压强p1和p2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小;根据图(2)判断,升高温度,化学平衡向吸热方向移动,再结合A的转化率判断该反应的正反应是放热还是吸热.
解答 解:由图(1)知,p2到达平衡时所用时间长,p1到达平衡时所用时间短,所用压强为p2的反应速率慢,为p1的反应速率快,压强越大反应速率越大,所以p2<p1;增大压强,化学平衡向气体体积减小的方向移动,由图象知,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x;
图(2)知,随着温度的升高,A的转化率减低,平衡向逆反应方向移动,升高温度,平衡向吸热反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即△H<0.
故答案为:<;>.
点评 本题考查化学平衡图象问题,为高频考点,侧重于学生的分析能力的考查,注意把握图象曲线变化,判断外界条件对化学平衡的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 在20℃,1.01×105Pa时,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | AgNO3、HCl、BaCl2、Na2CO3 | B. | HCl、BaCl2、AgNO3、Na2CO3 | ||
| C. | BaCl2、Na2CO3、AgNO3、HCl | D. | AgNO3、HCl、Na2CO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用灼烧的方法鉴别纯羊毛和合成纤维 | |
| B. | 没有水就没有生命 | |
| C. | 碳酸钡悬浊液可用作胃部X 射线透视的“钡餐” | |
| D. | 硅的导电性介于导体和绝缘体之间,晶体硅可用作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量铁粉的方法除去Cu(NO3)2溶液中混有的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 | |
| D. | 先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、OH-、CO32- | B. | Cl-、SO32-、Fe2+、H+ | ||
| C. | K+、Mg2+、SO42-、Cl- | D. | Na+、H+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池充电时,阴极反应式为:PbSO4+2e-=Pb+SO42- | |
| B. | 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 钢柱在水下部分比在空气与水交界处更容易腐蚀 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com